傳統中學化學實驗非電子式定量儀器多是簡單的滴定管、移液管、量筒、針管、秒表等。目前市面很多套件微型化學實驗儀器以一盒多件形式出售。大部份套件以塑料滴管、微型電解裝置、井穴反應板塊等為主要配件,可以作定量性測試的不多。因此有需要創新設計針對某課程實驗之微型定量儀器。
4.1 8井穴反應條 (8-well reaction strip) 及建議實驗 (11) 和 (12)
平底透明 8 井穴反應條 (圖 63) 微型化學實驗並不是新事物,早在數十年前北美國家中學已經採用了,但並不是用作主流實驗儀器。它有一個特點是把載有液體之井穴條倒轉後,在水面張力作用下,液體不會掉下來 (圖 64)。其他較大容量之井穴條不具這特性。
平底透明塑料8井穴反應條及其相關板塊 (圖 65) 是醫學化驗所必備之工具。可購買之平底透明塑料8井穴反應條很容易被折斷 (圖 66),不宜直接作學生實驗用。用一透明亞加力膠條施加小量化膠水 (即哥羅芳或三氯甲烷) (圖 67) 可令反應條變得堅固,不容易折斷。
(圖 64) 液體不會掉下來 | ||
(圖 66) 條塊容易折斷 | (圖 67) 用針筒施小量化膠水於井穴條和亞加力膠條之間 |
8井穴反應條在微型化學實驗有一特別用途。
一般化學反應速率實驗要在反應物溶液在不同濃度下進行個別實驗記錄反應時間,起碼實驗4 次 才可以作定量調研,要化一定時間。但如果利用 8 井穴反應條內之液體不下掉特性和一種叫 「下搖」 技巧 (“shake-down” technique),便可以在 同一時間 內做數次不同濃度之反應速率實驗,節省不少時間。
方法是置 9 小滴反應物於每一井穴之 A 條,也放置同容量之另一反應物於每一井穴之 B 條。輕輕倒置 A 條,小心覆蓋 A 條於 B 條上,並須使兩者之八個井穴都互相對準。雙手握住兩端,然後猛力把兩井穴條向下一搖,使 B 條的溶液落入 A 條內。最少兩次把 A 條和 B 條上下搖動確保溶液徹底混合 (「下搖」 技巧) 產生反應 (圖 68) 。

(圖 68) 「下搖」 技巧
DSE化學科課程課題九 “反應速率” 和課題十三 “工業化學” 都有涉及影響化學反應速率各種量化因素 ,如濃度 、温度等 。8穴反應條微型儀器對測定反應級數有獨特優點 ,可以極速測定速率與各反應物溶液濃度之量化關係 ,從而建立速率方程 。操作既有微量之特性,也有只用兩分鐘時間便可以完成整個實驗之快速測定優勢。
「碘時鐘反應」(詳述參閱實驗11) 之主體反應是H2O2 (aq) 和I– (aq) 離子氧化還原反應,化學方程為:
H2O2(aq) + 2I-(aq) + 2H+(aq) → I2(aq) + 2H2O(l)
反應物濃度改變和反應速率改變有正比例關係,其量化程度不只限於大和小兩種。應有一方程式,以濃度變數數字代入,可 計算 反應速率。反應速率和反應物濃度之量化方程式為:
Rate = k[I-(aq)][H2O2(aq)]
k 為反應常數。對 I–(aq) 離子和 H2O2(aq) 均為 1 級反應,對 H+(aq) 離子為 0 級反應而反應總級數為 2。利用 8 井穴反應條特性和創新之「1 2 4 8」 技巧,可巧妙地極速測定「碘時鐘反應」之各反應物之反應級數。
要注意一點:
因反應物用量微少,實驗结果很大程度取決於用量之準確性。以滴數取代容積實數,各滴容積會不一樣,因此微型實驗誤差會比一般傳統實驗誤差高。補救方法是多做幾次,取其平均值。
實驗 (11) 過氧化氫與碘離子在酸性溶液中的反應總級數(88頁)
「碘時鐘反應」
實驗 (12) 微型定量測定酸化硫代硫酸鈉之反應速率 (95頁) ,「消失交叉」

(圖 69)「消失交叉」實驗
4.2 小型加熱器快速測定 (碘時鐘反應) 活化能 (activation energy) 及建議實驗 (13)
量化反應速率或建立反應速率方程基本上要量化速率與溶液濃度和溫度之關係。主題 4.1 及建議實驗已探究了速率與個別及總反應物濃度反應級數 (kinetic order) 之關係。碘時鐘反應之速率方程式為 速率 = k[I(aq)–][H2O2],k 為速率常數。其實這方程只顯示速率與濃度之量化關係,沒有速率與溫度之量化關係。事實 k 並不是某反應常數,而是某反應速率與溫度的變數。速率常數和溫度之定量關係以阿列紐斯方程 (Arrhenius equation) 量化:k = Ae 其中 ΔHact為活化能 (activation energy),對某反應是一常數,數值越小,反應速率越快。A 和 R 均為通用常數。對數式方程為:
k = Ae ![]()
其中 ΔHact 為活化能 (activation energy),對某反應是一常數,數值越小,反應速率越快。A 和 R 均為通用常數。對數式方程為:
ln(k) = ln(A) –![]()
速率常數 k (k 可視為反應物濃度皆為單位數時之反應速度) ,和反應時間 t 成反比例,即 1/t。因此 ln(k) 和 ln(1/t) 也成比例。以上對數式方程可改寫為:
ln(1/t) = ln(A) –![]()
以ln (1/t) vs (1/T) 作一直線圖解,其斜率為 – ΔHact/R,從而計算 ΔHact。
綜合主題 4.1和 4.2,可以得出碘時鐘反應之完整速率方程式為:
Rate = (Ae![]() )([I-(aq)][H2O2(aq)])
)([I-(aq)][H2O2(aq)])
儀器製作
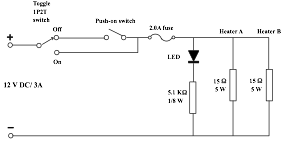
使用明火或水浴是中學實驗室常用的加熱水溶液方法 。若要求溶液準確地達到某一溫度,上述方法都很難辦到。理想方法是緩慢而反覆地加熱,例如電力恆溫水浴器 (automatic thermostat) 。使用低功率電阻低電壓,反覆地,慢慢地直接加熱溶液也可以達到目的 。電阻作為發熱器用以線阻最好 。以下電路以水泥電阻內之5W線阻發熱 (圖 70) 。
(圖 70) 小型加熱器線路圖
儀器组成: 一對小型電力加熱器 (探測器) (圖 72) 和一個控制面板 (圖 71) 。需要12V DC低壓電源 (12V AC也可以,但 LED 指示燈不會亮)。
 |  |  |
(圖 71) | (圖 72) | (圖 73) |
1. 小型電力加熱器
首先用硬物砸碎兩支阻值一樣之15 Ω 5W水泥電阻,取出內藏之線阻 (圖 74)。如 (圖 75) 和 (圖 76) 所示,用多層收縮膠圓通箍死。注意不要讓接線短路和 100%防水。探測器就是這樣的一對小型電力加熱器 (圖 77)
另一點更要注要的是只有在加熱器完全浸入水溶液情況下才可以通電加熱。
(圖74) | (圖75) | (圖76) | (圖77) |
2. 控制面板
控制面板主要為一預先鑽了數孔之木板和兩條鋁角 (圖 78和 79) 組成。需要之零件:
名稱 | 數量 |
| 5 mm黃色 LED 連座 | 1 |
| 黑色香蕉插座 | 4 |
| 二刀二擲切換開關 | 1 |
| 按鍵開關 (按下開/放手關) | 1 |
| 2A 保險絲連座 | 1 |
| 5 kΩ 1/8W 碳阻 | 1 |
首先把各類零件依不同位置用鉗子固定 (圖 80) ,用螺絲釘把鋁角上在木板
兩邊。按線路圖 (圖 70) 用電線把各接線點焊好 (圖 73) 。
(圖78) | (圖79) | (圖80) |
3. 儀器操作
注要:只有在加熱器完全浸入水溶液情況下才可以通電加熱
先把控制板面接上低壓電源,再把加熱探測器,一對香蕉插 (輸入A) 跟另一對香蕉插 (輸入B) 插好。A 加熱探測器放入大試管內有反應物 A 溶液。B 加熱探測器放入另一大試管內有容量一樣之反應物 B 溶液。置溫度計於其中一大試管。放置兩大試管於一燒杯,作隔熱用 (圖 81)。整個裝置如 (圖 82) 所示。通電第一步是啟動二刀二擲切換開關,待溶液 A 溫度上升至稍低於目標溫度後,關上二刀二擲切換開關,跟着重覆按下/放手按鍵開關直至剛好到達目標溫度。請參考實驗 (13) 實驗步驟。
| (圖81) | (圖82) |
實驗 (13) 過氧化碘時鐘反應活化能 (100頁)
4.3 微型相对分子质量套件 (RMM kit) 及建议实验 (14)
仪器说明
课题九“反应速率” 有题及摩尔体积为 24 dm3之计算。微型相对分子质量套件(图83) 为一创新快速测定常温常压下丁烷相对分子质量之微型仪器。计算公式用PV = ( ) RT。若已知丁烷之相对分子质量 (M),可以计算常温常压摩尔体积常数 (24 dm3)。
若称量出某气体体积(V) 之重量 (m),则可计算出气体之相对分子量 (M) 。RMM套件之实验误差率少于5%,实验值非常接近文献参考数据。若秤量器用分析度0.001克电子天枰,实验值会更为准确。
套件可用作学生实验,也可由显视仪作实时投影示范。
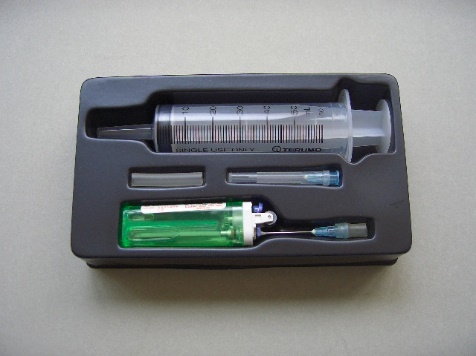
(图 83) 微型相对分子质量套件
| 套件组件有: |
|
套件组合放在一吸塑料盆上(图83)。
 |  |  |
(图 84) | (图 85) | (图 86) |
儀器操作非常簡單。
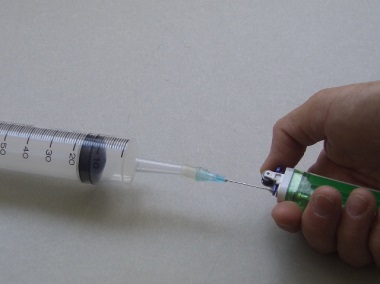
步骤: | 1. 首先称量丁烷打火机/针咀组合 (准确度± 0.01克) (图 84)。 2. 缓缓释放丁烷至塑料针筒,直至收集60 cm3 (图 85)。 3. 再次称量丁烷打火机/针咀组合 (图 86)。 4. 假设常温常压下之摩尔体积为24 dm3,基于所测量之丁烷质量和体积,试计算丁烷之相对分子质量。 |
实验结果和计算
丁烷打火机/针咀组合之起始质量 = 12.89 g
丁烷打火机/针咀组合之最后质量 = 12.75 g
释放丁烷之质量 = 0.14 g
释放丁烷之体积 = 60 ml
丁烷之相对分子质量 = [0.14 x ] = 56 g mol-1
(文献数据:(C4H10),相对分子质量 = 58 g mol-1)
实验百分比误差率 = = 3.4%
备注
丁烷打火机之喷咀用「超能胶」与注射针咀牢固地粘在一起。丁烷打火机可在各超级市场购买,要选择那些可放上吸塑料盆。
实验 (14) 测定常温常压 (r.t.p.)下之气体常数,R (105页)
释放丁烷
4.4 「电解管」 (electrolysis tube) 及建议实验 (15)
各地不同化学科课程都包括电解水这一课题。内容基本要求学生知道水可被直流电分解为氢气和氧气。释放之气体容积比例为 氢(2):氧(1)。电解化学式为:
负极 (-) : 4H+(aq) + 4e– → 2H2(g)
阳极 (+): 4OH–(aq) – 4e– → O2(g) +2H2O(l)
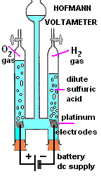
释放之氧气可重燃暗红木条 ,而氢气则可以引起 “爆鸣” 反应 。一般中学化学实验室之电解仪器,用于定量显示的多是传统之霍夫曼仪 “Hoffmann apparatus”,较为昂贵,因使用铂电极 (图 87,88)。学生实验定性用的一般是使用碳棒电极。优㸃是价廉,缺点是容易断裂,用作正电极也会被释放之氧气氧化腐蚀。
| (图 87) 霍夫曼仪 “Hoffmann apparatus” | (图 88) 霍夫曼仪示意图 |
课程 (2) 设计之「「电解管」 」(图 89) 不用碳电极而用镍铬合金线,即发热线 (nichrom wire)。优点是镍铬合金棒条作为电解正极不容易被氧化 (发热线加热至炽热后冷却回室温会变为原状,没有腐蚀现象)。缺点是电解质溶液只何以用氢氧化钠溶液而不何以用其他电解质溶液,因为镍铬合金线会对其他电解质溶液释放之气体有化学反应。中学化学科课程强调水溶液的电解总体,即释于放氢,氧和两者之容积比例。其他可能出现之产物皆要借助电化序 (electrochemical seies) 之离子释放次序解释。采用氢氧化钠溶液做实验一则符合设计需要,二则应对DSE化学课程七要求。设备还可作为一简单氢氧燃料电池。

(图 89)「电解管」
仪器制作
(1) 准备以下物料:(i) 兩枝一次性 5 cm3 针筒 (图 90),(ii) 透明热缩胶条,(iii) SWG 16 号铜棒,(iv) 镍铬合金线 (图 91),(v) (A+B) 型金属填料混合(图 92) ,(vi) 有两个 15 mm 直径孔之 8 mm 厚 PVC 胶条 (图 93) 。
(2) 用小鋸去掉 5 cm3 针筒顶部,用电烙铁和透明热缩胶管保护针筒 (图 94)。近针筒咀部钻两小孔方便释放压力 ,利用 “Blu Tack” 泥胶封口 (图95) ,其组合作用有如栓塞。
(3) 铜和镍铬合金线不能以锡焊接,只可以靠直接接触。方法是用刚好大小的热缩胶管重复地箍死,再用填料混合胶封口 (图 96) 。组合便是一条电解电极。
(4) 制备之电极透过针筒咀,再用填料混合胶封口 (图 97),完成一单元可收集气体电极棒。
(图 90) | (图 91) | (图 92) | (图 93) |
(图 94) | (图 95) | (图 96) | (图 97) |
(5) 两组制备之组合放入有两孔之PVC胶板条,再用填料混合胶粘死。完成之电极可以进行电解 (图 98) 。
(6) 装置刚好放于一100 cm3 烧杯 (图 99) 。
䦕始实验
(1) 首𠀡置约 80 cm35M NaCl溶液于100 cm3 烧杯,用小量 “Blu Tack” 封死两针筒管之小孔。双手拿着组合,引升一点,证实管内溶液没有下降才为合格,即没有气压差 (图 100) 。
(2) 开始电解 (图 101) 。
电解
(图 98) | (图 99) | (图 100) | (图 101) |
各类测试
a. 氢气和氧气之容积比例 (参考实验 15)

(图 102) 2:1 容积比
2 : 1 氫氧容积比
b. 测量生成之碱性氢/氧燃料电池之电动势 (参考实验 15)

(图 103) 碱性氢/氧燃料电池起始电动势
碱性氢/氧燃料电池电动势
c. 测量氢气 (爆鸣) (参考实验 15)

(图 104) (爆鸣) 实验
(爆鸣) 实验
d. 测量氧气 (参考实验 15)
 (图 105) 测量氧气
(图 105) 测量氧气
测量氧气
实验 (15) 定性和定量小型电解仪器 –「电解管」 (109页)
4.5 微型测量燃烧热套件 (microscale heat of combustion kit) 及建议实验 (16)
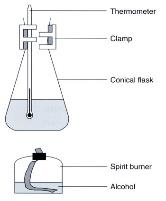
(图 106) 传统燃烧热测量装置
傳統燃燒熱測量裝置
上图是一般中学测量乙醇燃烧热或燃烧摩尔焓变之化学实验装置。称量已燃烧了的乙醇 (ethanol量度锥形瓶水温度上升的幅度便可用公式 DH = ms (DT) 计算乙醇之燃烧热。实验结果和文献误差相当大,主要原因是实验进行时有热流失。
测定乙醇燃烧热不一定要用水加热,加热固态对象如金属铝也可以。微型燃烧热测量套件用「双实验校对」技巧,基本消除实验时之热流失 (参考实验16)。
 |  |
| (图 107) | (图 108) |
燃烧摩尔焓变指可燃对象完全燃烧时释放之热能。汽油燃烧发热,提供内燃机动力。碳水化合物燃烧 (即消化 + 吸收 + 血氧作用) 则提供人类器官运动能量。测量可燃物质之燃烧摩尔焓变一般是把它真实地燃烧起来,所产生的热能令另外一件物件温度上升,从而计算可燃物质之燃烧摩尔焓变。
微型燃烧热测量套件由 (i) 玻璃小砵, (ii) 铝块热量计和 (iii) 温度计组成 (图107, 108)。
铝块热量计之制作
取一节实心圆铝条,长 26 mm,直径 38 mm, (图109)。一面正中钻一个直径6.2 mm洞,深度刚好放入一温度计 (图110)。另一面边缘三对称处各钻一个直径3.8 mm洞容纳一节直径3.8 mm长30 m铝条 (这铝条取自一根6.2 x 13 mm拉钉)。这面正中造一个直径约15 mm坑,目的是增加火熖和铝块之接触面积。
把这三条小铝条分别放入三个小洞,突出约20 mm,再用环氧树脂混合胶黏牢,作用像三只脚 (图111)。
|
|  |
(图 109) | (图 110) | (图 111) |
實驗 (16):測定propan-1-ol (1-甲基乙醇) 的燃燒摩 爾焓變 (114頁)
4.6 熔度计 (meltometer)
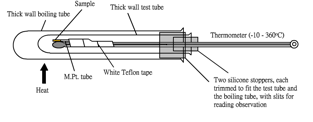
熔度计套件 (图114, 115) 为一设计新颖之溶点测量仪。与一般用油加热 (图 112 ) 或用电加热 (图 113 ) 之溶点测量仪不同,它只简单地用一大一小试管形成之空气空间直接用本生火熖加热。熔度计可测量高熔点或低熔点之固体,视乎仪器温度计之测量范围。熔度计较其他溶点测量仪更快地加热和冷却。
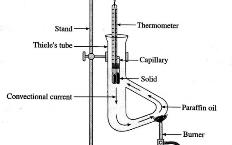 |  |  |
| (图 112) | (图 113) | (图 114) 熔度计 |
(图 115) | (图 116) | (图 117) | (图 118) |
熔度计套件之组合有: | 1. 一厚身试管 2. 一厚身大试管 3. 一水银注入式温度计 (-10 – 360o C) 4. 两个硅胶塞,分别修剪至合适试管和大试管 5. 一卷水喉胶布 6. 一把金属制放大镜 7. 一小试管内装10支熔点管 |
熔度计套件操作非常直接和简单
1. 戴上安全措施眼镜 2. 把粉状固体样本放入熔点管 3. 剪一段水喉胶布把熔点管贴近温度计之球部位置 (图118) 4. 利用小硅胶塞置熔点管/温度计组合于试管中 5. 利用大硅胶塞再置试管/熔点管/温度计组合于大试管中,容许两试管一些空间 6. 调校大小硅胶塞之位置令观察温度不受障碍 (图117) 7. 稍稍倾斜整个组合并用铁架夹紧 (图116) 8. 用大本生火熖加热整个组合之底部 9. 用附有之放大镜观察样本之状态 10. 当接近熔点时停止加热 11. 当样本变为熔液时 (呈透明状) 记录温度读数 12. 拆除装置 (还在高温状态),冷却回室温 13. 重复实验,取得可靠结果 |
注意:实验完毕后应等待足够时间令装置完全冷却才可放回容器里