科学仪器有定性和定量两大类。主题 2 列述常用之中学化学科实验定量和定性仪器,都是实验室标准设备,可从仪器供货商购买。主题 3 和主题 4 推荐之微型仪器不可以从仪器公司购买,必须自制。优㸃是 (i) 设计创新、(ii) 激发好奇心、(iii) 意识用量微小之好处、(iv) 承传微型实验之安全特性和 (v) 推广环保「绿色意识」。
本课程推广之微型化学实验仪器全部本地化,笔者或其他后继人士可组织工作坊,以课程 (1) 描述之各种技巧,用本地材料,配合适当条件,让参与工作坊教师亲自动手去组装。也可以把经验带回自己学校,利用自身资源造出同款多套仪器,供全班数个小组实验用,丰富学生实验技巧。科学实验离不开亲身体验,只观看示范或利用计算机虚拟操作皆不能促进科学的实质进步。
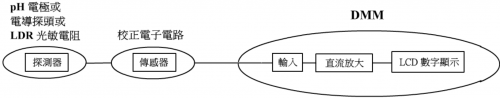
观察化学反应有多种定量变量。高中化学科课程化学实验有三大类化学反应需要量化,那就是 (i) pH值,(ii) 电导率和 (iii) 吸光度。分别要用酸度计,电导计和比色计。三款仪器有不同的显示单位,即pH,μS/cm 和Absorbance。仪器都有一共同点,就是必须先经过校正程序才可使用,不可以拿来即用,需要实验前花时间讲解。三款仪器都需要电子电路运作。
不少学生对电子式仪器有恐惧感,尤其高级精密仪器之各类显示单位形式。对于这方面之电子式仪器,本课程推荐「DMM显示技巧」。「DMM显示技巧」是指用同一万用数字表 (digital multi-meter, DMM) 作终端显示器,以数字显示 pH, 电导率和吸光率。以100 (无单位) 显示全电导或零吸光。设计之传感器 (sensor) 令使用者不用知晓各类显示单位原意,感觉简单、方便和 “user-friendly”,令学生对测量没有丝毫恐惧感。例如:若设计之比色计于实验时显示 79 mV,则有色溶液样本透光率可测定为100 mV空白校正之79/100。学生不用知悉 “Absorbance” 单位之意思。
有些学校自制简单LED显示电导现象 ,以光暗程度表示电导率 。这些简单设备对初中学生还可以 ,但高中化学科课程则需要量化的电导率 ,光暗程度不能量化。再者,LED 用直流电,产生电解效应。「DMM显示技巧」 于这方面之例子:把设计之电导计探头短路,调校DMM显示100 mV (满度校正步骤)。若实验溶液样本读数为 45 mV,则溶液电导率为 45%,不带任何单。学生也不用知悉 “μS/cm” 单位之意思 (参考实验 21) 。
5.1 锑电极 pH 酸度计 (antimony pH meter) 及建议实验 (17), (18), (19) 和 (20)
简介
定量测量水溶液 pH 值实质上是测量由置入溶液中电极形成化学原电池电动势 (e.m.f.) 之变化。目前, 仪器商供应的 pH 电极几乎全部都计采用组合玻璃电极 (combined glass electrode) 。工作原理是溶液 H+ (aq) 离子和玻璃膜形成之半电池与银/氯化银参考电极之半电池组合而成的原电池电动势随溶液 H+ (aq) 离子浓度改变而改变。不过玻璃电极的制造成本很高,资源有限制之中学很多负担不起购买多套 pH 计供学生使用。不用说玻璃电极的寿命有限, 容易破损,尤其是对不常用电字仪器,技巧欠佳之中学生而言。
早在上世纪开始时,已经证明以锑金属作为半电池电极在水溶液中会产生电动势。当溶液中 H+(aq) 离子浓度改变时,其半电池电极电动势也随者改变。这提供了另一种定量测定溶液 pH 方法。近年锑电极在医疗方面有发展,主要原因是这款电极可以微型化和相当准确地测量 pH 6 – 8 范围 (血液为一种缓冲溶液,pH 值为 7.4) 。
pH测量:锑电极对比玻璃电极
玻璃电极之运作机制早已有详细文献。但锑电极,因种种缺点,早已不被科学界采用作定量测定 pH 值,其运作机制再没有更新文献 。但考虑到中学化学科课程实验遇到之 pH 值范围较狭窄和学生对实验只有初步技巧 ,不易损坏之锑电极是个好选择,虽然其反应和准确度不及玻璃电极。
锑电极
下表依据标准电极电动势文献:
(A) 以标准氢电极为参考 (Ef = 0.000 V)
溶液 | 半电池还原半方程式 | Ef/V |
碱性 | SbO2– (aq) + 2H2O(aq) + 3e– | -0.639 |
中性或微酸性 | Sb2O3(s) + 6H+(aq) + 6e– 2 | +0.150 |
酸性 | SbO+ (aq) + 2H+(aq) + 3e– | +0.204 |
半电池电极电动势和溶液浓度之量化关系以能斯脱方程式 (Nernst equation) 表述。很明显,若上表依能斯脱方程式解读,锑电极随不同锑氧化态 (III),即SbO2–,Sb2O3 和 SbO+在不同酸度下输出之半电池电极电动势跟溶液 H+(aq) 浓度改变而改变,涵括整个 pH 值范围。仪器供货商提供之参考半电极近年全部采用银/氯化银电极,因此组合式玻璃电极 (combined glass electrode) 就是银/氯化银电极和玻璃电极浸在胶状缓冲液制造而成的 。课程 (2) 推荐之参考半电极是较方便和容易制作之铜/铜(II),即 Cu/Cu2+(aq) 半电极。
(B) 以标准Cu/Cu2+(aq)半电极为参考 (Ef = +0.340 V)
溶液 | 比较标准氢电极Ef/V | 比较标准Cu/Cu2+(aq)半电极Ef/V |
碱性 | -0.639 | – (+0.340 + 0.639) = – 0.979 |
中性或微酸性 | +0.150 | – (+0.340 – 0.150) = – 0.190 |
酸性 | +0.204 | – (+0.340 – 0.204) = – 0.136 |
使用锑电极测量酸度之原电池:
– +
Sb(s) | Sb(III) | H+ (aq) || Cu2+ (1M) | Cu(s)
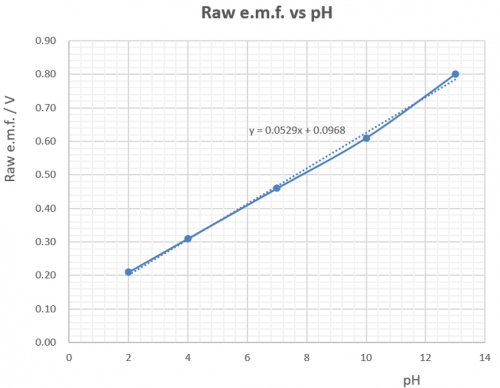
理论上 ,由 Sb/Sb(III) 半电池和 Cu/Cu(II) 参考半电池造成之原电池浸在水溶液产生电位差 (potential difference) ,涵盖 pH 值 1 至 1 3 范围。测量时,铜电极为正极,锑电极为负极。原电池产生之电位差由 0.136 V 至 0.979 V。
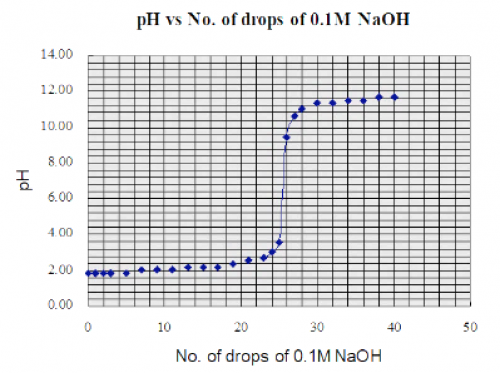
原电池产生之电位差用一般价廉之数字万用表 (digital multi-meter, DMM) 测量。测量结果和理论值有所偏差,但仍可接受。参考下图:
(图119) 原电池宽电动势vs pH
(i) 虽然图表直线高端有偏差,但整体线性还算很好,尤其是pH值由2至10之范围。 (ii) 有别于玻璃电极之极高内阻,锑电极内阻很低,输出之电位差稳定,便于测量,因此 (iii) 显示pH值较稳定。
玻璃电极
使用组合玻璃电极测量酸度之原电池:
+ –
Ag(s) | AgCl(s) | H+ (aq) || glass membrane | buffer solution | Pt(s)
大部份文献都确认玻璃电极之输出电动势 (e.m.f.) 与 pH 值有一直线关系,涵盖整个 pH 值范围,尤其由 pH 0 至 12 (不过极低 pH 值有酸性误差和极高 pH 值则有碱性误差) 。玻璃电极另一个优㸃就是玻璃膜不会被腐蚀。不过玻璃膜只可以通过微量电流,换句话说,玻璃电极有极高内阻 (最小也有1010 Ω)。只有输入阻抗极高之仪器才可以处理这样微弱讯号 。虽然现时蕊片输入阻抗可以达到1012 Ω,解决输入之问题。不过随着产生另一个很难解决问题,就是仪器变得很灵敏,容易受环境影响,即易受 “噪声” 干扰,仪器不稳定而复制同一数据也有难度。
总结
锑电极 | 玻璃电极 |
* 原电池 e.m.f. 和 pH 值 2 -12有近线性关系。 | * 原电池 e.m.f. 和 pH 值0 – 12 有全线性关系 ,除却酸性和碱性误差段。 |
* 原电池内阻低,要求不高之传统输入探测器便可使用。 | * 原电池内阻极高,输入需要BNC 型插头和插座。 |
* 反应较慢,低pH值灵敏度低。 | * 反应快,全pH值范围灵敏度高。 |
* 稳定,数据可复制 (reproducible) 。 | * 现时高科技制造术技可解决高阻抗输入问题,令数据显示稳定和可复制。虽然如此,玻璃电极酸度计仍不排除受外来干扰影响。 |
* 测量原理高中学生可以明瞭。 | * 测量原理属大学程度。 |
* 不易损坏。 | * 易损坏。 |
* 寿命取决于电极重量大小。 | * 电极寿命有限,取决于玻璃膜质素。 |
* 易被腐蚀。 | * 不易被腐蚀。 |
* 容易制造。 | * 要求高科技制造。 |
* 价廉。 | * 昂贵。 |
衡量上表列出之优决点 ,显然易见用锑电极量度 pH 值对高中学生是一个好选择。
创新「盐栓」
一般中学都用一小条滤纸浸满刚制备好饱和 KNO3 溶液作盐桥用 。本课程设计了另一方法代替盐桥,就是用一小节牙签浸透饱和 KNO3 溶液后凉干 。这个自制小东西便是创新「盐栓」,使用十分方便。首先用小胶滴管内有 1M CuSO4 溶液转移至小参考电极隔间内 (图120),小心滴至满溢 (图121)。把手把小 (盐栓) 牢牢封死隔间出口 (图122)。不容许隔间内有任何空间,因为这会令金属铜、Cu2+(aq) 和 「盐栓」电导不稳定。做完这步骤后便完成了 铜/铜(II) 参考电极 (图123)。
以往每次测试都需要更换一条新盐桥。但若用「盐栓」代替盐桥则不需要这样做,只要用水清洗「盐栓」后便可以再做另一次测试,直至完成整个实验为止。
 |  |  |  |
(图 120) | (图 121) | (图 122) | (图 123) |
实用锑电极测 pH 两种模式
(A)直读式
原理
顾名思义 ,直读式设计意思是 ,若溶液 pH 是4.0 ,仪器应显示 40,溶液 pH是7.0,仪器应显示 70,如此类推。
锑电极组合探测器 (probe) 原电池,即 Sb(s) | Sb(III) | H+ (aq) || Cu2+ (1M) | Cu(s),输出之电动势随溶液 pH 值改变而作线性改变。若把探测器直接输入DMM,会得到如 (图119) 之显示,不是直读式。
如要求有直读式显示,锑电极组合探探测器要先经过一个传感电路 (sensor circuit),才可以接上 DMM (图 124)。首先把 DMM 选择器转动至 DC 2000 mV满度一档,即最大可量度之输入电压为 2000 mV。锑电极组合若放入 pH = 4.0 溶液中,接上传感器和 DMM 后会显示 40 mV,若放入pH 7.0 溶液中,得到之显示为 70 mV ,如此类推 。这种技巧就是 「DMM 显示技巧」。设计原理并不新颖,但技巧是创新的。
(Fig. 124) 「直读式」pH 测量显示图
锑电极测量 pH 准确性和灵敏度都不高,只可作为中学实验而设计。因此数字显示㸃数后一个位准确性刚好。换句话说,显示 pH 为 7.26 不切实际,只可显示为 7.3。这方面之要求使传感器要有一组电阻衰减器 (attenuator)。传感器线路 (图126) 会有描述。
传感器设计
虽然图解原电池e.m.f. vs pH有线性关系 (图119) ,但直线并不通过 (0, 0) 原㸃。因此线性关系不成正比例,在OY轴有一0.09V 截距 (intercept)。传感器要消除这偏差。传感器两主要工作:
(i) 提供一 – 0.097 V电源,减去原电池电动势,令修正后之电动势趋势直线可以通过 XY (0 0) 点。修正电动势和pH值作正式线性比例,实现0 pH 输入 / 0 V 输出条件。
(ii) 完成 (i) 任务后,还要用一固定电压增幅 (voltage gain) 把修正电动势线性放大 (「壹㸃校正」) 令传感器总输出达致10 mV/ pH。换句话说,这样才可以把 pH 3.5 显示成 35 mV或 pH 6.6 显示成 66 mV 等等。
需要电压放大之增幅可如下计算 (参考 图 125,126):
考虑 pH 7.0: (i) 修正电压 = (0.46 – 0.097) V = 0.36V。(ii) 这数字值电压要放大至 0.70V,电压增益 = 0.70/0.036 = 1.94。传感器要满足 (i) 和 (ii) 之要求。传感器电子线路会在下一章详细描述。原电池处理可总结如下表:
pH | 原 e.m.f./V | 修正 e.m.f./V |
2 | 0.21 | (0.21 – 0.097) = 0.11 |
4 | 0.31 | (0.31 – 0.097) = 0.21 |
7 | 0.46 | (0.46 – 0.097) = 0.36 |
10 | 0.61 | (0.61 – 0.097) = 0.51 |
13 | 0.80 | (0.80 – 0.097) = 0.70 |
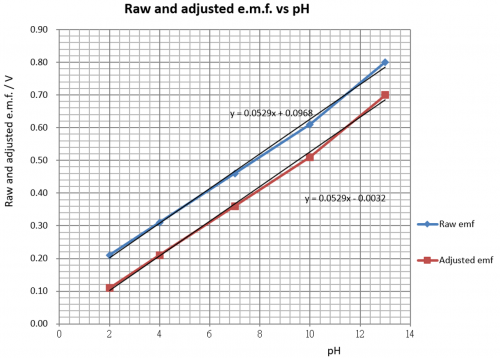
(图125) 原e.m.f. 和修正 e.m.f. vs pH
pH | 修正e.m.f./V | 「壹㸃校正」 | 放大倍数 | 放大后电压 /V | 衰减后电压 /mV | 诠释pH值 |
2 | 0.11 | — | — | (0.11 x 1.94) = 0.21 | 21 | 2.1 |
4 | 0.21 | — | — | (0.21 x 1.94) = 0.41 | 41 | 4.1 |
7 | 0.36 | 0.70V | 0.70/0.36 = 1.94 | (0.36 x 1.94) = 0.70 | 70 | 7.0 |
10 | 0.51 | — | — | (0.51 x 1.94) = 0.99 | 99 | 9.9 |
13 | 0.70 | — | — | (0.70 x 1.94) = 1.36 | 136 | 13.6 |
校正步骤需要pH = 2, 4, 7, 10 和13 之缓冲溶液 (buffer solution)。0.100 M NaOH 溶液可视作 pH 13 缓冲溶液。
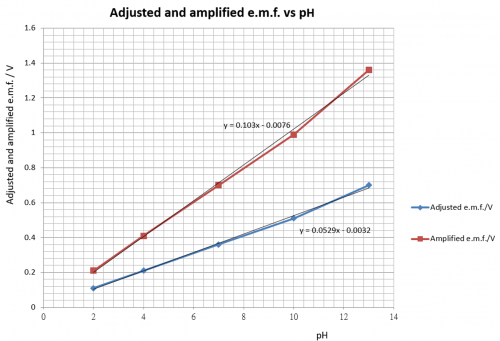
(图126) 修正和 「壹点校正」 之e.m.f. vs pH
因为只选用一个 pH 值作校正,这方法也叫 「壹㸃」校正。校正准确度不及 「两㸃」校正,即取两个 pH 值作校正。但基于锑电极准确度比不上玻璃电极和方便原因,「壹㸃」 校正对锑电极是很合适的。校正电压放大1.94 倍后,感器输出电压便达致100 mV per pH,即 pH 7.00 显示为 700 mV, pH 4.47显示为 447 mV,如此类推。稍前有所陈述,锑电极测量 pH 只可以提供一点数位准绳度,因此有需要把输出电压衰减九成 (即乘以1/10)。总结果为输出电压达致10 mV/pH。pH 7.00 显示为 70 mV,pH 4.47 显示为 45 mV,如此类推。
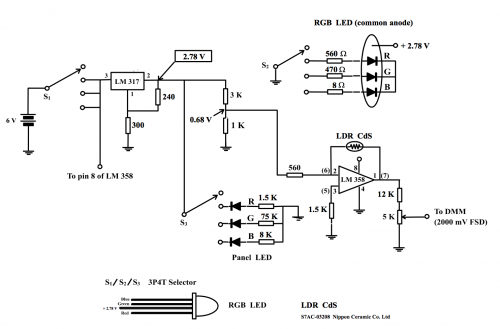
传感器线路和工作原理
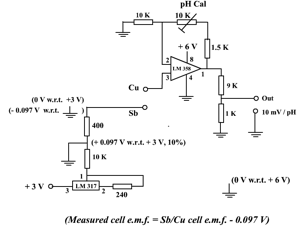 (图127) 传感器线路
(图127) 传感器线路
(i) 传感器线路电源
传感器线路需要两个电源。一个 (3V) 供给可调控稳压器LM 317 产生参考负电压,另一个 (6V) 为运算放大器LM 358提供Vcc。3枚3V钮扣形锂电池正好符合这要求。串联其中二枚提供6V电源。选用LM 317 是因为这款可调控稳压器可输入低电压 (即3V)。放大阶段采用线性双运算放大器LM 358是因为此IC只需要一组电源 (即不需要另一负6V电源)。
(ii) 负参考电压
可调控稳压器LM 317和周边电阻连接,提供稳定参考电压。400W 电阻分压出来之电压产生稳定参考 + 0.097 V (课程 (1), 91页)。若把这正参考电压连上6V电源之地(即 6V 负极) 接连,则3V电源之地接头便可输出 – 0.097 V (相对6V电源之地)。施加这负电压可校正原电池电动势为正比例放大作准备。虽然LM 317 不是一枚标准参考电压IC,但也可以长期提供稳定输出电压。容易购买和价廉也是选用之原因。
(iii) 校正原电动势
如 (图119) 所示,没有校正之原电动势,即电极完全没有电子电路处理,其电动势vs pH直线不通过 (0, 0) 点,在 OY 轴有一 0.097 V截距。若电极接上- 0.097 V电压,修正的直线 (红线) 便通过 (0, 0),而其直线是一正比例线。测量pH 时,LM 358第3脚 (non-inverting input) 连接Sb/Cu原电池之正极 (Cu)。原电池之负极 (Sb) 则接上- 0.09V (图 127)。结果是把Ecell 和 – 0.09V两个电压相加起来, Sb/Cu原电池之有效电动势变为 (Ecell – 0.097)V。理论上,有效电动势之作图直线应经过 (0, 0) 原点 (图 128,红线)。
(图128) 原e.m.f. 和修正 e.m.f. vs pH
(iv) 放大校正电动势和「壹点校正」
修正之原电池电动势需要进一步适当地作线性放大令DMM显示数字可诠释作pH值。因为放大输入为正电压而输出也是正电压,所以采用非反相放大线路 (课程 (1) 主题 8.3.2 (b),82页) 。连接非反相输入端 (non-inverting input) ,即第 3 脚。配合第1 脚和第2脚,即 (1.5 K + 10 K可变电阻) 和10 K接地之间电阻组合 (图127) ,输出电压由10 K可变电阻控制。适当的阻值由10 K可变电阻调校。这阻值视乎缓冲溶液之 pH 值而定。仪器设计只限由一个 pH 值校正。如选 pH 7 时,调校10K可变电阻至1脚输出端为 700 mV 便要固定下来,不再转动。传感器便达至「壹点校正」。这时传感器之输出符合 100 mV/pH 条件 (图 129 红直线) 。
(图129) 修正和 「壹点校正」 之e.m.f. vs pH
(v)「壹点校正」后续
锑电极准确度不高,显示pH值不宜准绳至小数后两位,即显示pH 7.4而不是pH 7.38等等。这问题不难解决,只要于LM 358输出第1脚接上一9 :1衰减电阻组合便可以了。即串联9K和1K电阻,之间抽头作最后电压输出。这么一来,1脚若输出0.738V会变成0.0738 V了而DMM 2000 mV FSD 则显示为74 mV,即显示 100 mV/pH 变为 10 mV/pH。不过要显示74 mV (即视作pH值为7.4) 之前还要把DMM选择项旋钮转至2000 mV满度才行,否则看不见74 mV 显示。加了衰减电阻组合后,传感器之输出符合 10 mV/pH 条件。
(vi) 步骤总结
首先调校DMM旋钮至DC 2000 mV满度一档。跟着进行 「壹点校正」, 置准备好之 Sb/Cu 组合电极于 pH 7 缓冲溶液中,探头输出接上传感器,旋转 pH Cal 10K 可变电阻至 DMM 显示 70 mV。「壹点校正」 完毕 (图 130) ,可以开始实验,测试任何水溶液之 pH 值。例如 Sb/Cu 组合电极放入 pH 5.5 溶液中,DMM 会显示 55 mV (视作 pH 5.5) ,如此类推。总之,设计最后条件是传感器于0 pH 时 输出 0 mV而跟随之变化为 10 mV/ pH。

(图130)「壹点」 pH 7 校正
(vii) 传感器装配
自制仪器之重要目的是以本地资源完成制作。前设是掌握有关课程 (1) 之各种手工和电子技巧。 课程 (1) 主题15 和课程 (2) 主题8列举香港热门电子零件,工具和物料集中地点,非常容易按信息购买各类零件物料。香港是购物天堂,电子零件也不例外。一般电子零件价钱不跟通胀上升,反之随时间增长而下降。运算放大器IC一般只售十元左右 (2020年价格)。通用数字万用表 (DMM) 也很便宜,不用一佰港元。
整个传感器线路耗电量很小,三颗 (CR 2032) 纽扣形锂电池分别提供主线路电源和负参考电压电源。用几滴化胶水 (trichloromethane) 把一PVC胶条黏贴三个纽扣形锂电池座,两个 (6V) 作LM 358 Vcc 和 Vee电源,一个 (3V) 作负参考电压电源 (图 132)。
按图127 之线路完成焊接各款电子零件于万用线路板上 (图 131)。整个装置放入一10 cm x 6 cm x 2.5 cm 仪器胶盒内 (图132至133)。因零件盒细小,只靠接线和各组件占据之空间互相靠拢,盖上盒子盖子便可把整体装置固定下来,不用修螺丝,自身固定。
 |  |  |
| (图131) 焊接电子零伴于万用PCB上 | (图132) 胶盒内部‧3枚钮扣形锂电池标签为1,2和3 | (图133) 完成品 |
锑电极 和 铜/铜(II) 参考电极之制造
(1) 锑电极
置金属锑粉 (AR grade) 于坩埚内,于烟橱内强力加热至融化 (图134) 。用移液管胶泵或针筒把融化锑缓缓吸上一小节玻璃小管。炽热之液态锑在管内凝结,形成一条金属锑小棒。之后弄碎玻璃管,把小金属锑棒取出。锑棒很易断裂,分成数节小锑棒。准备好之小锑棒焊接上一节供导电铜棒 (锑很易上锡)。除了前后两端,其他部位都被双层收缩胶箍死绝缘。完成制造锑电极 (图135) 。 |
(图134) 强力加热坩埚内之锑粉 |
(2) 铜/铜(II) 参考电极
铜/铜(II) 参考电极制作如下:把一节铜棒和一小段玻璃管用混合胶封死,玻璃管内留一小隔间用来填满用小滴管注入之1M硫酸铜溶液。一小节「盐栓」代替传统盐桥。「盐栓」是一小节木牙签浸透饱和KNO3溶液跟着凉干。参考 (图120至121)。要注意一㸃是隔间内不容许小汽泡,否则电极导电程度不稳定 (图137)。 |
(3) 完成之组合锑电极
(图138) 完成之锑/铜 (II) 组合电极
检视上图可不用多解释便明了组合锑电极之运作原理。组合锑电极可轻易放入24井穴板进行实验。
实验 (17):组合锑电极酸度计 「壹点校正」 (119页)
实验 (18):强酸vs强碱滴定曲线 (0.1M HCl vs 0.1M NaOH) (121页)
实验 (19):弱酸vs强碱滴定曲线 (0.1M CH3COOH vs 0.1M NaOH) (125页)
(B) 基本模式
测量原理
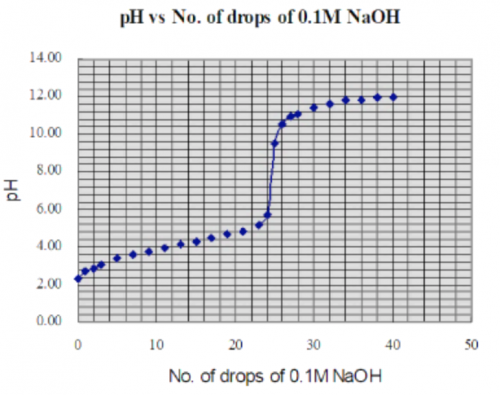
除了使用传感器连接DMM测量pH,其实一个较简单方法是不用传感器,组合锑电极产生之讯号电压直接输入DMM。需要用另一种全 pH 校正方法。首先要用不同 pH 值 (2,4,7,10,13) 缓冲溶液建立一 pH 值校正图 (图139) 。
(图139) 原e.m.f. vs pH 校正图
(i) 延伸 (图139) 直线至 pH 0 和 pH 14 得全 pH 值校正图。若组合锑电极测量到0.14 V,从延伸图可推断 pH = 1.00,如此类推。
(ii) 借助计算机软件MicroSoft Excel,建立 pH 校正直线回归斜率。输入电压 = 0.14 V,可得 pH = 1.00
实验 (20):组合锑电极酸度计基本校正和量度 pH (127页)
5.2 微型电导计 (micro-scale conductance meter) 及建议实验 (21) 和 (22)
初中和高中化学课程部有主题涉及溶液电导率,例如电解和电导滴定。有一点要特别注意:低压直流电通过溶液会产生电解,分解电解液,不宜作定量分析溶液。溶液电导量化实验一定要用交流电。
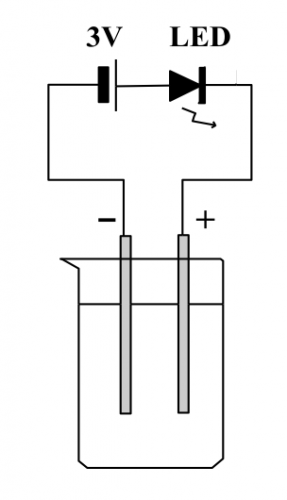
(图140) LED 溶液电导装置
很多中学化学溶液电导测试实验都用上图 LED 之光暗程度来显示电解质溶液浓度之变化。这是一个又简单又有效之装置,对推广初中学生参于实验有帮助。不过,DSE 化学科课程有关溶液电导主题不仅需要定性分析,也需要定量测量,不可以量度时伴随电解。显然 (图140) 装置不符合DSE 化学科课程之要求。
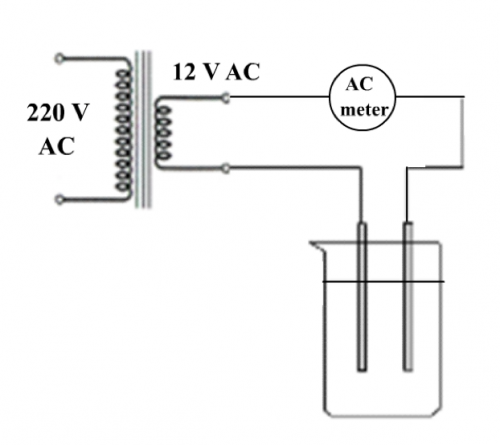
(图141) 低压交流电电导计
市电源经变压器变为低压交流电后才电导便不会产生电解,跟着设计一简单电导计如 (图 141) 所示 ,是一个可行的解决方法 。这方法 既传统 ,不创新 ,也不方便。现时中学理科实验室学生工作台之低压设备是直流电压 ,不宜直接驳做电导实验,要在电源外接低压变压器,操作不方便。
微型电导计之设计特式

(Fig. 142) 微型电导计
(i) 设计采用「DMM 显示技巧」,以一廉价数字万用表 (DMM) ,数字显示实验最终结果。电子仪器采用这技巧十分适合中学定量化学实验测量溶液pH值、溶液电导率和有色溶液吸光度。测量基本原理是这类探测器输出之电源讯号,经过适当放大,可以配合一般数字万用表 (内阻不小于10 MW, 只耗用少量输入电源) 作相当准确数字显示。
(ii) 一般电导计仪器显示单位为「mS/cm」。中学按课程授课不会解释这单位意思。学生做实验时面对这些仪器便有问题了。设计之电导计弃用单位概念。当探测器短路时 (即全电导) ,调校DMM 显示 100 mV,完成电导计100 满度校正 (没有单位) 。若测量样本溶液时显示 34 mV,可视作样本溶液之电导率为全电导之34/100 (图 143) 。设计满足「用家友善」条件,令仪器操作技巧不甚称职之中学生也放心进行定量实验。
(iii) 线路设计总输出约500 mV,衰减至 385 mV (参阅54 页)。满度校正除定为 100 mV外,也可提升至 300 mV。这方法增加仪器准确度。举个例:同条件下,若甪100 mV 满度校正测得41 mV,甪300 mV 满度校正则可显示为124 mV,多一数位准绳。
(iv) 探测器导电时不可伴随电解 (图 164) ,因此需要AC电源。设计之传感器有一弛张振荡电路,产生高频方波脉冲讯号链作导电电源 (图 152) 。
(v) 传感器后级采用电压随耦器 (voltage follower) 电路 (课程 (1) 主题3.1 72页) 。此类缓冲性电路可消除噪声和输出低漂移电压。

(图143) 以微探测器、传感器、24井穴板和DMM显示溶液电导率为百分之34
仪器制作
(1) 电导探测器 (conductance probe)

(图 144) 专业电导探测器
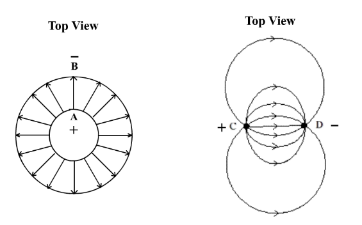
一般专业电导计探头 (图 144) 采用金属同心圆柱筒作电导电极,因为电导时圆柱筒间之电场线可平均垂直地分布,满足电导率线性计算之要求 (图145)。经校正后,可计算样本溶液电导率 (局限于特定温度下低浓度。真实复杂数学定量考虑涉及溶液全部可移动离子,包括相同极性和不同极性离子,网上搜寻)。专业电导计内置电子电路机制,以「mS/cm」单位显示溶液电导率。课程 (2) 微型电导计之设计原意是自制,圆柱筒形探头制作不简单,不符合自制要求。
两条绝缘发热线棒 (nichrome wire) 可造成一个简单平行电极电导探测器。发热线棒C和 D之电场线分布并不垂直,而是曲线形的 (图146)。但这不重要,要点是电场分布要有规律 。(图146) 发热线棒 C和 D之电场符合这方面要求 。若采用同专业电导计探头校正方法是不可以计算溶液电导率。不过,图表校正同计算校正一样有效。非直线校正图表也可计算溶液电导率。注意:导电不可伴随电解,因此必需使用AC 电源,这也是传感器设计一个主要目的。
| |
| (图145) 圆柱A和B间之电场线平均垂直地分布,符合电导率/浓度线性量化计算要求。 | (图146) 两棒间之电场线有规律地作曲线形分布。电导率/浓度图解不呈直线,不可依公式计算。 |
平行式金属棒条形电极制作不难。一式可放入96井穴板井穴之微型电导探头可以如下步骤制作:
(a) 准备两条长约13厘米硬度适中nichrome wire (即发热线) 作电导电极。采用发热线作电极是因为当发热线通电至高温发红随着冷却后会发现它返回原来样子,没有丝毫腐蚀。因此发热线较其他金属线条 (铂除外) 更能抗拒腐蚀,更有惰性,尤其处于水或空气中。
(b) 把其中一条发热线用收缩胶加热箍死绝缘,只露出两端小部份作电导用。
(c) 另外一条发热线不用处理,把这两条发热线同时放入一根大小10厘米长之玻璃管,管之两端要突出电导部份。两端用填料混合胶封死 (图147)。不作探头那端套上一节亚加力胶管,一个作用是使玻璃管不易断裂,另一个作用只是为外观。
(d) 亚加力胶管那端接上电缆导线作讯号输出。要注意一点是发热线不上锡,导线之铜线和发热线要用收缩胶加热箍死绝缘。有需要时用热融胶整体包封。再用收缩胶加热箍死玻璃管段完成制作 (图148)
| (图147) 电导探头,大小与牙签比较 | (图148) 完成之电导探测器 |
(2) 传感器 (The sensor)
组装传感器前置条件是掌握课程 (1) 陈述之手工和电子技巧。传感器三大组成 (i) 一弛张振荡电路产生高频讯号作为 AC 电源、(ii) 全波 AC 整流电路和 (iii) 一后级电压随随耦器 (voltage follower) 电路输出稳定电压。整个流程如下图所示:
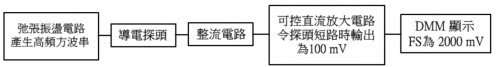
(图149) 采用 「DMM 显示」 技巧微型电导计流程图
(i) 弛张振荡器
传感器主部件是弛张振荡讯号产生器。设计采用「黑盒」处理方法,即着眼于输入 / 输出要求。手头上有运算于放大器 IC、电容器和电阻,要组合产生一5000 Hz 方波讯号作AC电源。重温课程 (1) 主题 8.3.2 (e) 陈述之「弛张振荡器」,其标准电路如下图所示:
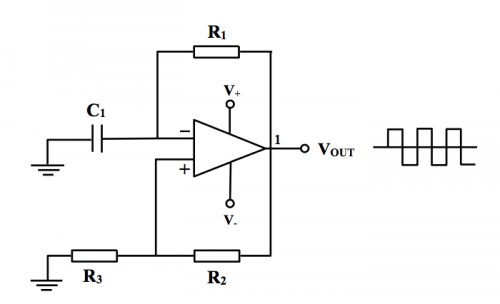
(图 150) 标准弛张振荡器电路
计算弛张振荡器产生频率之方程式为:
![]()
(ii) 传感器电路
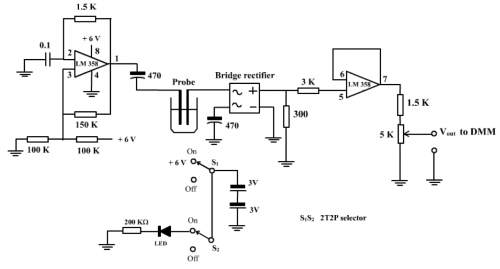
(图151) 微型电导计传感器线路图
(iii) 电路工作原理
微型电导计传感器线路工作原理可分三大部份考虑:
(a) 一组 LM 358 (第 1、2和3脚) 接驳成弛张振荡器,产生之方波频率为:
![]()
代入C1、R1、R2 和R3 数据便可以计算频率。 C1= 0.1mF,R1 = 1.5K, R2 = 150K, R3 = 100K, 计算之频率为
![]()
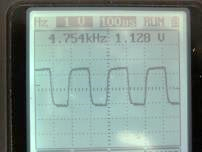
(图152) 线路图振荡器输出之方波,因电阻数值误差,显示略少于 5 KHz
(b) 输出方波交流电源通过探测器,经样本溶液,全波整流改为只有上半波之直流。
(c) 整流后之直流电压透过 3K电阻输入接成电压随耦器 (voltage follower) 之另一组LM 358 (第5、6和7脚),输出 1:1 电压增值之稳定电压。探测器短路时,7脚测得500 mV电压输出。经 1.5K 和 5K可变电阻串联组合,于 5K 可变电阻抽取 0 至385 mV (500 x mV = 385 mV) 。100、200 或300 满度校正皆可由此输出得以达致。方法是首先把探测器短路,调校5K可变电阻至DMM显示100 mV或200 mV或300 mV便可。举个例子:100满度校正显示40 mV的样本溶液电导率视作溶液之电导率为全电导之40/100。若选择200满度校正,DMM显示80 mV,也就是说灵敏度提高了。这种使用方法特显无单位「DMM显示技巧」之优越性。
(iv) 完整传感器装配
(a) 万用印刷线路板和零件组合
差不多全部电子零件都可以焊接在一小块万用印刷线路板。焊接前先要准备好各零件之最合适位置。要伸出引线焊接其他线路板以外之零件如5K可变电阻,6V电源盒,开关,LED指示,输入和输出插座 (图153,154)。
 |  |
(图153) 完成焊接之万用印刷线路板 (正面) | (图154) 完成焊接之万用印刷线路板 (背面) |
(b) 6V电池盒
为了可以在细小机盒内收藏 ,仪器设计采用两枚3V钮扣形锂电池 (CR 2032,图 155) 作电源。这款电池有专用之电池座 (图156)。两座电池座串联后用化胶水黏贴于一小块亚加力PVC胶片上 ,成为一另类电池盒 (图157)。因传感器工具盒细小,电池座自由地安放,不用黏贴,也可固定下来 (图161)。
 |  |  |
| (图155) 6V电池电源 | (图156) 仪器工具盒 | (图157) 盒面孔穴 |
(c) 仪器工具盒
整个传感器装置放入一个100 x 60 x 25 mm PVC专业仪器工具盒内 (图158)。盒面适当位置钻不同大小孔洞以安装 5K可变电阻,照明指示LED和微型 push-on / push-off 开关 (图159)。盒低盘两侧一边钻一孔容纳探头插座,接探头电缆插头。另一边钻另一孔容纳输出用DC插座,接DMM。
| (图158) 盒底孔穴 | (图159) 完成各孔穴工具盒 |
(d) 整体传感器组装
盒面装上5K可变电阻并套上旋钮。把焊接好之万用印刷线路板电缆引线接上钮扣形6V锂电池电源 ,LED,5K可变电阻,微型push-on / push-off开关,探头插座,DC插座 。接线与接线间暴露处用一小节收缩胶加热箍死绝缘。线路板和其他零件接线可整体放入工具仪器盒,自身固定 (图 161)。
(图160) 盒面背部和线路板连接线 |
「短路校正」步骤
首先选择DMM 2000 mV 输入。接上传感器输入和输出。把一根金属条将探头短路。调校传感器旋钮至DMM显示 100 (图162)。旋钮固定下来,不再旋转,完成 100 满度校正。
| (图161) 100满度「短路校正」方法一 |
 |
| (图162) 100满度「短路校正」方法二 |
测试溶液电导率
若把探头放入某电解溶液,DMM显示29 mV,表示这溶液之电导率为全电导之29% (图163)。观察测试时探头不产生任何电解作用 (图164)。
| (图163) 显示溶液电导率为百分之29 | (图164) 测试时探头不产生电解 |
实验 (21): 电解质溶液电导率探究 (134页)
实验 (22): 电导滴定 (141页)
5.3 一台负担得起、灵敏度高、稳定性强和工作友善之比色计 (colorimeter) 及建议实验 (23)、(24)、(25)、和 (26)
引言
人类双眼视觉可分辨物体距离和立体感 (对光波相位差敏感) 和有色液体颜色之深浅 (对光波波幅敏感) 。因此眼睛是一个优良天然比色计,不过虽然眼睛以定性分辨颜色分类 ,但是它只可以辨别有色液体颜色之深浅而不可以量化颜色亮度程度,我们可以辨别一件绿色物体之绿色为相当深色,但不能标签它的绿色是5度深或6度深 (如果有)。虽然如此,人们仍可以靠眼睛检视法半定量测量有色溶液之浓度。
1. 目视法估量 KMnO4 溶液浓度
| 1. | 用移液管转移10 cm3 4 x 10-3 M KMnO4入试管 (1) 。 |
| 2. | 从试管 (1) 移10 cm3入另一试管,加相同容量蒸馏水,搅拌好并标签为试管 (2) 。 |
| 3. | 从试管 (2) 移10 cm3入另一试管,加相同容量蒸馏水,搅拌好并标签为试管 (3) 。 |
| 4. | 重复步骤 (3) 4 次,从而准备试管 (5,6,7,8) 。下表列出各试管之溶液浓度: |
试管 | KMnO4 浓度 / x 10-4mol dm-3 |
1 | 40.00 |
2 | 20.00 |
3 | 10.00 |
4 | 5.00 |
5 | 2.5 |
6 | 1.25 |
7 | 0.625 |
8 | 0.3125 |
| 5. | 置 8 试管于一线排列,放入试管架或用透明胶贴黏在一起 (图165)。 |
| 6. | 置末知浓度之KMnO4溶液 (溶液X) 接近排列。目视决定排列某试管颜色最接近溶液X。X之浓度便假定是某试管之浓度。 |
2. 比色计量度有色溶液浓度
以上之目视法可见人类眼睛就是一个天然的比色计 。方法虽然简单 ,但却带出一个重要步骤,就是调校或校正。(图162) 是一块调校板,用实验品对比一下可推测实验品浓度 。视觉神经运作虽然极之神秘复杂 ,但作为传感器,它只可以辨别颜色和深浅,没有调校功能。量化有色溶液浓度需要人工仪器,那就是 比色计 。比色计原理和眼睛之视觉神经有㸃相似 ,不过以光敏电阻和电路作为传感器记录单色光源强度透过有色溶液之浓度变动令光敏电阻阻值改变作定量分析。比色计传感器要经过调校后才可以运作,不可以一拿起就用。
3. 一台负担得起、灵敏度高、稳定性强和工作友善之比色计
(A) 仪器设计特色
(i) 设计之比色计采用「DMM显示技巧」。用市面价廉之万用数字电表 (digital multi-meter, DMM) 作不同实验终端显示。这创新方法于主题5.1 和5.2已经论及,今次再次应用于测量有色溶液之吸光度。这款仪器就是常用之比色计 (colorimeter)。一如前两款传感器之设计理念,今次之比色计传感器也控制电压输出为2000 mV以下,再微调输出从0 mV 至100 mV。只取其数字,即没有单位,为实验数据结果。
(ii) 一般比色计显示单位为 「吸光度」 (absorbance) 或 「透光率」 (transmittance) 。「吸光度」 为一量化光强度单位 ,要知悉其相关对数方程式 ,即要懂比尔定律 (Beer’s law) 。高中化学科课程主题不常有,因为要做实验而化时间讲解单位 ,不如令数据不附带单位 。「DMM显示技巧」 正好符合这方面要求。这款比色计线路设计是溶液无颜色时 ,传感器输出为100 mV (图 168) ,近全黑色时为 0 V (图 169) 。若某有色溶液输出为 66 mV (图170) ,则这有色溶液之透光率为无色百分之66 ,如此类推 。设计可为仪器操作流畅度稍逊之学生提供一个迁就用家或工作友善 (“user-friendly”) 工作环境。
(iii) 和一般中学比色计不同,设计不用试管而采用专业比色杯 (图 168) 。
(iv) 传统比色计采用 RGB 单色光滤光片 。实验时要选择适合之滤光片放入滤光片槽 ,产生单色光 。继蓝色 LED 普及后,三色 LED 发出之红、绿、蓝三色非常接近单色光,可以取代 RGB 单色光滤光片。因此这款比色计采用三色 LED 作光源 (图 167) 。
| (图166) 塑料比色杯和传感器 | (图167) RGB三色LED光源和比色杯槽 | (图168) 空白样本透光率 |
| (图169) 全吸收后之透光率 | (图170) 比色测量进行中 |
(B) 传感器线路
(图171) 比色计传感器线路
(C) 电源
比色计电路电源不仅要供应 Op-Amp LM 358,也要供应三色 LED。后者需要较多电力,因此不宜用3 V钮扣形薄电池,要用传统电力较多之碳锌 AAA电池。串联 4 枚 AAA 电池得 6 V 作总电源电压。三色 LED 光源要稳定才可以令传感器电路输出稳定 ,因此要用稳压 IC 稳定电源 。线路采用可控稳压IC LM 317 稳定电源电压 。LM 317 要输出低于 3 V之稳定电压 ,免去烧毁 LED 风险。(图 168) 240 W 和 300 W 电阻组合使 LM 317 输出脚 (2) 电压穏定于 + 2.78 V 。公式计算应是:
![]()
但电阻数值误差令输出为2.78 V。LM 358电源不需要稳压, 因为一般Op-Amp linear IC 对供应电源电压都容许大程度之差别,在一定范围内输出都很稳定。
(D) 线路描述
(i) RGB LED 选择单色光波长
用 3P4T 选择器控制 (i) 电源开关,(ii) 选择红色单色光 (主要 625 nm),(iii) 绿色单色光 (主要 520 nm) 或 蓝色单色光 (主要 470 nm)。.
(ii) Op-Amp LM 358 输入
一组Op-Amp LM 358 (第1、2和3脚) 接成反相放大模式,第 2 脚接输入讯号。预设输入电压为 + 0.7 V。稳压器 LM 317 第 2 脚电压为 2.78 V,输出接一 3 K 和 1K 电阻串联组合,抽头和地可得 [2.78 x (1/4 )] V 或 0.7 V。但电阻串连接线路其他组成,抽头处电压测得0.61 V而不是0.7 V。因反相放大器输入正压而不是负压,输出电压要计算多些而不是简单的Vout = Vin (R2/R1 )。参考下段。
(iii) 电压放大和光源调校
LDR CdS光敏电阻 (图174) 是传感器的核心零件。于绿色LED 光源下它的阻值约 3.5 KΩ,光源被遮挡下约 45 KΩ。反相放大电阻组合,即 560 Ω 和 LDR (R) 之电压增益为 (R/560) ,换句话说,(i) 一般光源下增幅约 (-35000/560) 和 (ii) 黑环境下增幅约 (-45,000/560) 。即增幅范围由约 (- 6) 至 (- 80)。 重温课程(1) 主题8.3.2(b) 。
因 560 Ω 输入电阻之输入电压不是负压而是 + 0.68V,所以于LM 358 第 1 脚总输出电压要如以下计算:
基于计算电压需要考虑「地」(即实质 0 V 或 6V 电源之负极) ,但是反相放大器相关计算之「地」并不是 0 V而是 LM 358 (-) 端或第 2 脚。这处视作「地」之电位差因此也称作「虚地」 (virtual ground) 。基于这原因,第3脚, 即 (+) 端输入,要产生与第 2 脚相同之电压才可匹配2脚之「虚地」。 第 3 脚和实质地接一电阻 (偏置电阻,bias resistor) 便可纠正这一偏差,阻值计算如下:
![]()
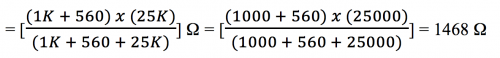
当被绿色单色光照射时, LDR 之电阻约 3.5 KΩ 而 560 Ω 电阻两端测量之电位差为 0.047 V。这数值电压放大至约 [(0.047) x (- 6)] V 或 – (~ 0.282) V。因此 LM 358 总输出第 1 脚,透过 560 Ω 和1 KΩ,与 6 V 电源「地」之电位差为 (图 169) :
第一脚输出电压 = [0.68 + (0.047) + (~ – 0.282)] V = ~ 0.445 V,即 ~ 445 mV。
由 5K 可变电阻控制之总输出电压幅度 = 0 V 至 [(445) x (5/17)] mV = 0 至 131 mV
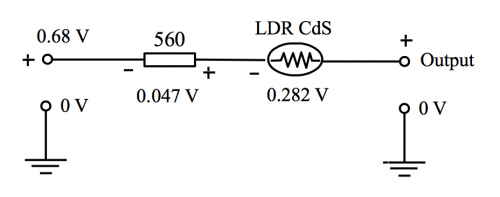
(图 172) 反相放大电压和相等极性线路
近全黑时, 输入电压为 0.738 V。LDR 之电阻约 45 K Ω ,而560 Ω电阻两端测量之电位差为 0.0089 V。这数值电压放大至 ~ [(0.0089) x (- 80)] V 或 ~ – 0.712 V。因此 LM 358 总输出第 1 脚和 6 V 电源「地」之电位差为 [0.738 + (0.0089 + (~ – 0712)] V = ~ 0.035 V,即 ~ 35 mV。
由 5K 可变电阻控制之总输出电压幅度 = 0 V 至 [(35) x (5/17)] mV = 0 至 10 mV
35 mV 至 445 mV 输出范围经 12K Ω 和 5K Ω 可变电阻可调校为0 – 100 mV 满度显示 (DMM 选择 2000 mV FSD) 。换句话说 ,比色计若选择绿色单色光 ,放入只盛载清水 (蒸馏水或去离子水) 之比色杯 ,再调校 5K Ω 可变电阻令 DMM 显示 100 mV ,固定旋钮位置便完成比色计对绿色单色光之校正了。
(iv) 电路评价
因全部讯号输入都靠稳压 IC LM 317 之输出,所以全电路稳定性决定于光敏电阻 LDR 之质量。设计采用 Nippon Ceramic Co. Ltd. 生产之S7AC – 03208光敏电阻,灵敏度和稳定性良好。整体而言,设计之仪器有较高显示复制性(high display reproducibility) 和低数据漂移 (drift) 。LM 358 为一低压单电源Op-Amp IC,设计之最低供压 Vcc 为 3V。只要供压不低于 4V,全线路供压,包括经 LM 317 稳压后供应 RGB 三色LED 之2.78 V电源和LM 358 第2 脚输入之 + 0.7 V都非常稳定。若换了4枚全新AA电池 (1.5V @),仪器可长时间连续运作。
(E) 比色计原型制作详情
(i) 塑料工具盒
全部组件收藏于一 (203 x 105 x 41) mm 面盖连底座塑料工具盒。面盖钻不同大小孔洞 ,容纳 (i) 3P4T 选择器,(ii) 板面 RGB LED , (iii) 比色杯入口 ,(iv) 5K W 可变电阻和 (v) 输出 DC 插座 (图 173) 。
(ii) 电源和电池座
于底座适当位置用热融胶黏实 4 位 AA 电池座。放入 4 枚AA 锌碳电池 (图174) 。
|  |  |
(图173) 工具盒和不同大小孔穴 | (图174) 工具盒面、底和电池座 | (图175) 药水樽、盖和一节颈部 |
(iii) 单色光光源
蓝光 LED 近年才普及。市面出售之三色 (红、绿和蓝) LED 提供耗电量低 、易购买 、小巧 、价廉和接近单色光光源 。接上低于 DC 3 V 电源产生红 (625 nm) 、绿 (520 nm) 和蓝 (470 nm) 近似单色光光源, 远较使用 RGB 三色滤光片为佳 。如一般 LED,RGB 三色 LED 对电源电压承受幅度有限 ,不可高于 3V DC,否则会烧毁。
(iv) 比色杯舱
选择一款 (60 cm3) 胶药水樽 (或其他胶樽),樽口刚好套入一 (12.5 x 12.5 x 45) mm 比色杯。弄掉药水樽顶部,黏上一小节 PVC 胶圈,制成一个比色杯适配头,再把这组合黏上盖面之比色杯洞穴上 。把四 PVC 胶条安置成井字形 (图 176) ,用 PVC 胶水黏贴好 。这组合中心方形正好让比色杯通过 。把这井字组合黏贴盖面底部 (图 177) 。这个井字形组合比色杯舱可令比色杯安稳地从舱口放入。
(图176) 井字形组合 | (图177) 井字形组合黏贴盖面 | (图178) U形黑色亞加力膠座和三色LED加LDR組合 |
(v) 三色 LED光源和 LDR接受座
用化胶水把三块厚身黑色亚加力胶板条牢固黏贴,形成一U 形座。U 座之两相对垂直围墙各钻一孔安放三色 LED 和 LDR (图 178) ,三色 LED 对准LDR。适当位置用强力黏合剂把 U 座黏紧工具底座,形成一完整比色杯舱 (图 179)。比色杯放入杯舱后不容许丝毫移动,否则 DMM 显示会不稳定。
(图179) 亚加力胶舱配合比色杯组装 | (图180) 万用线路板布局 | (图181) 焊接万用线路板和比色计底座分离展示 |
(vi) 零件安排布置和线路焊接
整个线路 (图 171) 可焊接于一块万用线路板上 (图 180) 。考虑安排布线时要顾及简易维修度 。如此,万用线路板和工具盒面便可轻易拆卸,离开底座 (图 181) ,方便维修 。设计风格各人不同,不过方便程度是主要考虑。最后一点提醒,零件间接口日久会松弛或甩脱,失去接触,引致电路失灵。补救方法可用热融胶或绝缘喷剂封闭接口。
(F) 准备实验
(i) 仪器校正
仪器校正就是每次实验前之 DMM 显示满度 (100 mV) 校正。
选择单色光
开启传感器和DMM并选择 DC 2000 mV FS ,连接感器和DMM 。比色杯装约 3/4满去离子水,放入比色杯舱 (比色杯舱两光滑面要分别面向RGB LED 和 LDR),盖好盖子。旋转 3P4T选择器选择红LED,调校 5K W 可变电阻至显示 100 mV。
移走去离子水,注入 同一 比色杯3/4满样本溶液。记录DMM读数,例如 85 mV。选择另一单色光,例如绿色 LED并记录DMM读。剩余之蓝色LED重复上述步骤。决定那单色光源少于或等于 85 mV。这单色光源就是要选择之光源。棕色或紫色溶液要用绿单色光。
确定满度校正
选择已确定之单色光源。置一内注3/4 满去离子水比色杯于比色杯舱。调校5K W 可电阻变阻至 DMM 显示 100 mV (图 182) 。移去比色杯,用不透明物件阻挡光源并记录比色计于近全黑环境下之 DMM 读数 (图 183) 。
|
|
|
|
| (图182) 空白测试 | (图183) 光阻塞源测试 |
(图184) 66% 透光率 |
实验 (23): 定量测定高锰酸钾 (KMnO4) 浓度 (146页)
实验 (24): 测定不含酒精饮料的食物色素的含量 (154页)
实验 (25): 强碱溶液酚酞退色反应级数 (159页)
实验 (26): 酸性溶液过氧化离子氧化碘离子之反应级数 (166页)