科學儀器有定性和定量兩大類。主題 2 列述常用之中學化學科實驗定量和定性儀器,都是實驗室標準設備,可從儀器供應商購買。主題 3 和主題 4 推薦之微型儀器不可以從儀器公司購買,必須自製。優㸃是 (i) 設計創新、(ii) 激發好奇心、(iii) 意識用量微小之好處、(iv) 承傳微型實驗之安全特性和 (v) 推廣環保「綠色意識」。
本課程廣之微型化學實驗儀器全部本地化,筆者或其他後繼人士可組織工作坊,以課程 (1) 描述之各種技巧,用本地材料,配合適當條件,讓參與工作坊教師親自動手去组裝。也可以把經驗帶回自己學校,利用自身資源造出同款多套儀器,供全班數個小組實驗用,豐富學生實驗技巧。科學實驗離不開親身體驗,只觀看示範或利用電腦虛擬操作皆不能促進科學的實質進步。
觀察化學反應有多種定量變數。高中化學科課程化學實驗有三大類化學反應需要量化,那就是 (i) pH值,(ii) 電導率和 (iii) 吸光度。分別要用酸度計,電導計和比色計。三款儀器有不同的顯示單位,即pH,μS/cm 和Absorbance。儀器都有一共同點,就是必須先經過校正程序才可使用,不可以拿來即用,需要實驗前花時間講解。三款儀器都需要電子電路運作。
不少學生對電子式儀器有恐懼感,尤其高級精密儀器之各類顯示單位形式。對於這方面之電子式儀器,本課程推薦「DMM顯示技巧」。「DMM顯示技巧」是指用同一萬用數字錶 (digital multi-meter, DMM) 作終端顯示器,以數字顯示 pH, 電導率和吸光率。以100 (無單位) 顯示全電導或零吸光。設計之傳感器 (sensor) 令使用者不用知曉各類顯示單位原意,感覺簡單、方便和 “user-friendly”,令學生對測量沒有絲毫恐懼感。例如:若設計之比色計於實驗時顯示 79 mV,則有色溶液樣本透光率可測定為100 mV空白校正之79/100。學生不用知悉 “Absorbance” 單位之意思。
有些學校自製簡單LED顯示電導現象 ,以光暗程度表示電導率 。這些簡單設備對初中學生還可以 ,但高中化學科課程則需要量化的電導率 ,光暗程度不能量化。再者,LED 用直流電,產生電解效應。「DMM顯示技巧」 於這方面之例子:把設計之電導計探頭短路,調校DMM顯示100 mV (滿度校正步驟)。若實驗溶液樣本讀數為 45 mV,則溶液電導率為 45%,不帶任何單。學生也不用知悉 “μS/cm” 單位之意思 (參考實驗 21) 。
5.1 銻電極 pH 酸度計 (antimony pH meter) 及建議實驗 (17), (18), (19) 和 (20)
簡介
定量測量水溶液 pH 值實質上是測量由置入溶液中電極形成化學原電池電動勢 (e.m.f.) 之變化。目前, 儀器商供應的 pH 電極幾乎全部都計採用組合玻璃電極 (combined glass electrode) 。工作原理是溶液 H+ (aq) 離子和玻璃膜形成之半電池與銀/氯化銀參考電極之半電池組合而成的原電池電動勢隨溶液 H+ (aq) 離子濃度改變而改變。不過玻璃電極的製造成本很高,資源有限制之中學很多負擔不起購買多套 pH 計供學生使用。不用說玻璃電極的壽命有限, 容易破損,尤其是對不常用電字儀器,技巧欠佳之中學生而言。
早在上世紀開始時,已經證明以銻金屬作為半電池電極在水溶液中會產生電動勢。當溶液中 H+(aq) 離子濃度改變時,其半電池電極電動勢也隨者改變。這提供了另一種定量測定溶液 pH 方法。近年銻電極在醫療方面有發展,主要原因是這款電極可以微型化和相當準確地測量 pH 6 – 8 範圍 (血液為一種緩衝溶液,pH 值為 7.4) 。
pH測量:銻電極對比玻璃電極
玻璃電極之運作機制早已有詳細文獻。但銻電極,因種種缺點,早已不被科學界採用作定量測定 pH 值,其運作機制再沒有更新文獻 。但考慮到中學化學科課程實驗遇到之 pH 值範圍較狹窄和學生對實驗只有初步技巧 ,不易損壞之銻電極是個好選擇,雖然其反應和準確度不及玻璃電極。
銻電極
下表依據標準電極電動勢文獻::
(A) 以標準氫電極為參考 (Ef = 0.000 V)
溶液 | 半電池還原半方程式 | EΦ/V |
| 鹼性 | SbO2- (aq) + 2H2O(aq) + 3e- | -0.639 |
| 中性或微酸性 | Sb2O3(s) + 6H+(aq) + 6e- | +0.150 |
| 酸性 | SbO+ (aq) + 2H+(aq) + 3e- | +0.204 |
半電池電極電動勢和溶液濃度之量化關係以能斯脫方程式 (Nernst equation) 表述。很明顯,若上表依能斯脫方程式解讀,銻電極隨不同銻氧化態 (III),即SbO2–,Sb2O3 和 SbO+在不同酸度下輸出之半電池電極電動勢跟溶液 H+(aq) 濃度改變而改變,涵括整個 pH 值範圍。儀器供應商提供之參考半電極近年全部採用銀/氯化銀電極,因此組合式玻璃電極 (combined glass electrode) 就是銀/氯化銀電極和玻璃電極浸在膠狀緩衝液製造而成的 。課程 (2) 推薦之參考半電極是較方便和容易製作之銅/銅(II),即 Cu/Cu2+(aq) 半電極。
(B) 以標準Cu/Cu2+(aq)半電極為參考 (EΦ = +0.340 V)
溶液 | 比較標準氫電極EΦ/V | 比較標準Cu/Cu2+(aq)半電極EΦ/V |
| 鹼性 | -0.639 | – (+0.340 + 0.639) = – 0.979 |
| 中性或微酸性 | +0.150 | – (+0.340 – 0.150) = – 0.190 |
| 酸性 | +0.204 | – (+0.340 – 0.204) = – 0.136 |
使用銻電極測量酸度之原電池:
– +
Sb(s) | Sb(III) | H+ (aq) || Cu2+ (1M) | Cu(s)
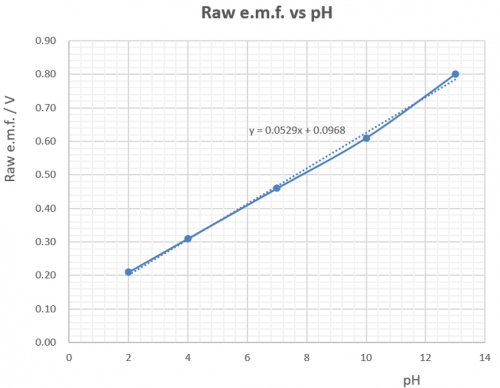
理論上 ,由 Sb/Sb(III) 半電池和 Cu/Cu(II) 參考半電池造成之原電池浸在水溶液產生電位差 (potential difference) ,涵蓋 pH 值 1 至 1 3 範圍。測量時,銅電極為正極,銻電極為負極。原電池產生之電位差由 0.136 V 至 0.979 V。
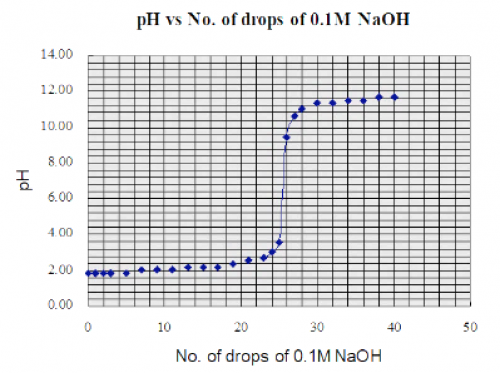
原電池產生之電位差用一般價廉之數字萬用錶 (digital multi-meter, DMM) 測量。測量结果和理論值有所偏差,但仍可接受。參考下圖:
(圖119) 原電池宽電動勢vs pH
(i) 雖然圖表直線高端有偏差,但整體線性還算很好,尤其是pH值由2至10之範圍。 (ii) 有別於玻璃電極之極高內阻,銻電極內阻很低,輸出之電位差穩定,便於測量,因此 (iii) 顯示pH值較穩定。
玻璃電極
使用組合玻璃電極測量酸度之原電池:
+ –
Ag(s) | AgCl(s) | H+ (aq) || glass membrane | buffer solution | Pt(s)
大部份文獻都確認玻璃電極之輸出電動勢 (e.m.f.) 與 pH 值有一直線關係,涵蓋整個 pH 值範圍,尤其由 pH 0 至 12 (不過極低 pH 值有酸性誤差和極高 pH 值則有鹼性誤差) 。玻璃電極另一個優㸃就是玻璃膜不會被腐蝕。不過玻璃膜只可以通過微量電流,換句話說,玻璃電極有極高內阻 (最小也有1010 Ω)。只有入阻抗極高之儀器才可以處理這樣微弱訊號 。雖然現時蕊片输入阻抗可以達到1012 Ω,解決輸入之問題。不過隨著產生另一個很難解決問題,就是儀器變得很靈敏,容易受環境影響,即易受 “雜訊” 干擾,儀器不穩定而複製同一數據也有難度。
總結
銻電極 | 玻璃電極 | ||
| * | 原電池 e.m.f. 和 pH 值 2 -12有近線性關係。 | * | 原電池 e.m.f. 和 pH 值0 – 12 有全線性關係,除卻酸性和鹼性誤差段。 |
| * | 原電池內阻低,要求不高之傳統輸入探測器便可使用 | * | 原電池內阻極高,輸入需要BNC 型插頭和插座。 |
| * | 反應較慢,低pH值靈敏度低 | * | 反應快,全pH值範圍靈敏度高 |
* | 穩定,數據可複製 (reproducible) |
* | 現時高科技製造術技可解決高阻抗輸入問題,令數據顯示穩定和可複製。雖然如此,玻璃電極酸度計仍不排除受外來干擾影響。 |
| * | 測量原理高中學生可以明瞭 | * | 測量原理屬大學程度。 |
| * | 不易損壞 | * | 易損壞 |
| * | 壽命取決於電極重量大小。 | * | 電極壽命有限,取決於玻璃膜質素。 |
| * | 易被腐蝕 | * | 不易被腐蝕 |
| * | 容易製造 | * | 要求高科技製造 |
| * | 價廉 | * | 昂貴 |
衡量上表列出之優決點 ,顯然易見用銻電極量度 pH 值對高中學生是一個好選擇。
創新「鹽栓」
一般中學都用一小條濾紙浸滿剛製備好飽和 KNO3 溶液作鹽橋用。本課程設計了另一方法代替鹽橋,就是用一小節牙籤浸透飽和 KNO3 溶液後涼乾。這個自製小東西便是創新「鹽栓」,使用十分方便。首先用小膠滴管內有 1M CuSO4 溶液轉移至小參考電極隔間內 (圖120),小心滴至滿溢 (圖121)。把手把小 (鹽栓) 牢牢封死隔間出口 (圖122)。不容許隔間內有任何空間,因為這會令金屬銅、Cu2+(aq) 和 「鹽栓」電導不穩定。做完這步驟後便完成了 銅/銅(II) 參考電極 (圖123)。
以往每次測試都需要更換一條新鹽橋。但若用「鹽栓」代替鹽橋則不需要這樣做,只要用水清洗「鹽栓」後便可以再做另一次測試,直至完成整個實驗為止。
 |  |  |  |
(圖120) | (圖121) | (圖122) | (圖123) |
實用銻電極測 pH 兩種模式
(A) 直讀式
原理
顧名思義 ,直讀式設計意思是 ,若溶液 pH 是4.0 ,儀器應顯示 40,溶液 pH是7.0,儀器應顯示 70,如此類推。
銻電極組合探測器 (probe) 原電池,即 Sb(s) | Sb(III) | H+ (aq) || Cu2+ (1M) | Cu(s),輸出之電動勢隨溶液 pH 值改變而作線性改變。若把探測器直接輸入DMM,會得到如 (圖119) 之顯示,不是直讀式。
如要求有直讀式顯示,銻電極組合探探測器要先經過一個傳感電路 (sensor circuit),才可以接上 DMM (圖 124)。首先把 DMM 選擇器轉動至 DC 2000 mV滿度一檔,即最大可量度之輸入電壓為 2000 mV。銻電極組合若放入 pH = 4.0 溶液中,接上傳感器和 DMM 後會顯示 40 mV,若放入pH 7.0 溶液中,得到之顯示為 70 mV ,如此類推 。這種技巧就是 「DMM 顯示技巧」。設計原理並不新穎,但技巧是創新的。
(Fig. 124) 「直讀式」pH 測量顯示圖
銻電極測量 pH 準確性和靈敏度都不高,只可作為中學實驗而設計。因此數字顯示㸃數後一個位準確性剛好。換句話說,顯示 pH 為 7.26 不切實際,只可顯示為 7.3。這方面之要求使傳感器要有一組電阻衰減器 (attenuator)。傳感器線路 (圖126) 會有描述。
傳感器設計
雖然圖解原電池e.m.f. vs pH有線性關係 (圖119),但直線並不通過 (0, 0) 原㸃。因此線性關係不成正比例,在OY軸有一0.09V 截距 (intercept)。傳感器要消除這偏差。傳感器兩主要工作:
(i) 提供一 – 0.097 V電源,減去原電池電動勢,令修正後之電動勢趨勢直線可以通過 XY (0 0) 點。修正電動勢和pH值作正式線性比例,實現0 pH 輸入 / 0 V 輸出條件。
(ii) 完成 (i) 任務後,還要用一固定電壓增幅 (voltage gain) 把修正電動勢線性放大 (「壹㸃校正」) 令傳感器總輸出達致10 mV/ pH。換句話說,這樣才可以把 pH 3.5 顯示成 35 mV或 pH 6.6 顯示成 66 mV 等等。
需要電壓放大之增幅可如下計算 (參考 圖 125,126):
考慮 pH 7.0: (i) 修正電壓 = (0.46 – 0.097) V = 0.36V。(ii) 這數字值電壓要放大至 0.70V,電壓增益 = 0.70/0.36 = 1.94。傳感器要滿足 (i) 和 (ii) 之要求。傳感器電子線路會在下一章詳細描述。原電池處理可總結如下表:
pH | 原 e.m.f./V | 修正 e.m.f./V |
2 | 0.21 | (0.21 – 0.097) = 0.11 |
4 | 0.31 | (0.31 – 0.097) = 0.21 |
7 | 0.46 | (0.46 – 0.097) = 0.36 |
10 | 0.61 | (0.61 – 0.097) = 0.51 |
13 | 0.80 | (0.80 – 0.097) = 0.70 |
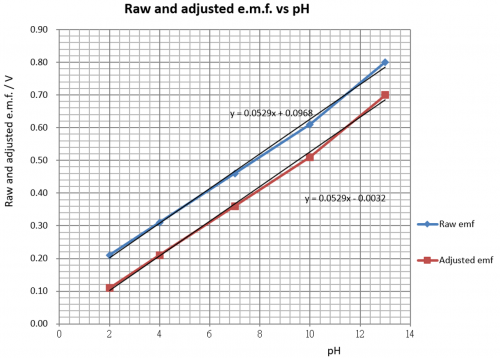
(圖125) 原e.m.f. 和修正 e.m.f. vs pH
pH | 修正e.m.f./V | 「壹㸃校正」 | 放大倍數 | 放大後電壓 /V | 衰減後電壓 /mV | 詮釋pH值 |
2 | 0.11 | — | — | (0.11 x 1.94) = 0.21 | 21 | 2.1 |
4 | 0.21 | — | — | (0.21 x 1.94) = 0.41 | 41 | 4.1 |
7 | 0.36 | 0.70V | 0.70/0.36 = 1.94 | (0.36 x 1.94) = 0.70 | 70 | 7.0 |
| 10 | 0.51 | — | — | (0.51 x 1.94) = 0.99 | 99 | 9.9 |
13 | 0.70 | — | — | (0.70 x 1.94) = 1.36 | 136 | 13.6 |
校正步驟需要pH = 2, 4, 7, 10 和13 之緩衝溶液 (buffer solution)。0.100 M NaOH 溶液可視作 pH 13 緩衝溶液。
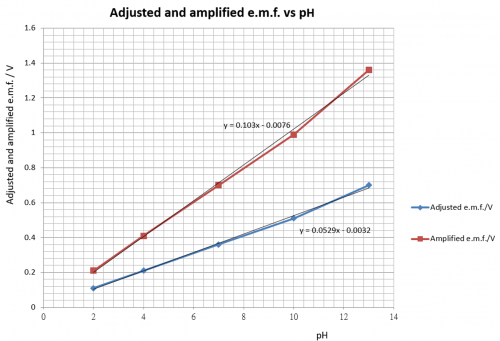
(圖126) 修正和 「壹點校正」 之e.m.f. vs pH
因為只選用一個 pH 值作校正,這方法也叫 「壹㸃」校正。校正準確度不及 「兩㸃」校正,即取兩個 pH 值作校正。但基於銻電極準確度比不上玻璃電極和方便原因,「壹㸃」 校正對銻電極是很合適的。校正電壓放大1.94 倍後,感器輸出電壓便達致100 mV per pH,即 pH 7.00 顯示為 700 mV, pH 4.47顯示為 447 mV,如此類推。稍前有所陳述,銻電極測量 pH 只可以提供一點數位準繩度,因此有需要把輸出電壓衰減九成 (即乘以1/10)。總結果為輸出電壓達致10 mV/pH。pH 7.00 顯示為 70 mV,pH 4.47 顯示為 45 mV,如此類推。
傳感器線路和工作原理
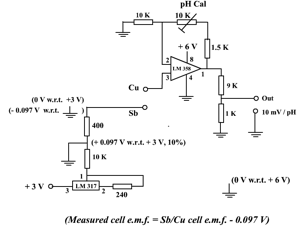 (圖127) 傳感器線路
(圖127) 傳感器線路
(i) 傳感器線路電源
傳感器線路需要兩個電源。一個 (3V) 供給可調控穩壓器LM 317 產生參考負電壓,另一個 (6V) 為運算放大器LM 358提供Vcc。3枚3V鈕扣形鋰電池正好符合這要求。串聯其中二枚提供6V電源。選用LM 317 是因為這款可調控穩壓器可輸入低電壓 (即3V)。放大階段採用線性雙運算放大器LM 358是因為此IC只需要一組電源 (即不需要另一負6V電源)。
(ii) 負参考電壓
可調控穩壓器LM 317和周邊電阻連接,提供穩定參考電壓。400W 電阻分壓出來之電壓產生穩定參考 + 0.097 V (課程 (1), 91頁)。若把這正參考電壓連上6V電源之地(即 6V 負極) 接連,則3V電源之地接頭便可輸出 – 0.097 V (相對6V電源之地)。施加這負電壓可校正原電池電動勢為正比例放大作準備。雖然LM 317 不是一枚標準參考電壓IC,但也可以長期提供穩定輸出電壓。容易購買和價簾也是選用之原因。
(iii) 校正原電動勢
如 (圖119) 所示,沒有校正之原電動勢,即電極完全沒有電子電路處理,其電動勢vs pH直線不通過 (0, 0) 點,在 OY 軸有一 0.097 V截距。若電極接上- 0.097 V電壓,修正的直線 (紅線) 便通過 (0, 0),而其直線是一正比例線。測量pH 時,LM 358第3腳 (non-inverting input) 連接Sb/Cu原電池之正極 (Cu)。原電池之負極 (Sb) 則接上- 0.09V (圖 127)。结果是把Ecell 和 – 0.09V兩個電壓相加起來, Sb/Cu原電池之有效電動勢變為 (Ecell – 0.097)V。理論上,有效電動勢之作圖直線應經過 (0, 0) 原點 (圖 128,紅線)。
(圖128) 原e.m.f. 和修正 e.m.f. vs pH
(iv) 放大校正電動勢和「壹點校正」
修正之原電池電動勢需要進一步適當地作線性放大令DMM顯示數字可詮釋作pH值。因為放大輸入為正電壓而輸出也是正電壓,所以採用非反相放大線路 (課程 (1) 主題 8.3.2 (b),82頁) 。連接非反相輸入端 (non-inverting input) ,即第 3 腳。配合第1 腳和第2腳,即 (1.5 K + 10 K可變電阻) 和10 K接地之間電阻組合 (圖127) ,輸出電壓由10 K可變電阻控制。適當的阻值由10 K可變電阻調校。這阻值視乎緩衝溶液之 pH 值而定。儀器設計只限由一個 pH 值校正。如選 pH 7 時,調校10K可變電阻至1腳輸出端為 700 mV 便要固定下來,不再轉動。傳感器便達至「壹點校正」。這時傳感器之輸出符合 100 mV/pH 條件 (圖 129 紅直線) 。
(圖129) 修正和 「壹點校正」 之e.m.f. vs pH
(v)「壹點校正」後續
銻電極準確度不高,顯示pH值不宜準繩至小數後兩位,即顯示pH 7.4而不是pH 7.38等等。這問題不難解決,只要於LM 358輸出第1腳接上一9 :1衰減電阻組合便可以了。即串聯9K和1K電阻,之間抽頭作最後電壓輸出。這麽一來,1腳若輸出0.738V會變成0.0738 V了而DMM 2000 mV FSD 則顯示為74 mV,即顯示 100 mV/pH 變為 10 mV/pH。不過要顯示74 mV (即視作pH值為7.4) 之前還要把DMM選擇項旋鈕轉至2000 mV滿度才行,否則看不見74 mV 顯示。加了衰減電阻組合後,傳感器之輸出符合 10 mV/pH 條件。
(vi) 步驟總結
首先調校DMM旋鈕至DC 2000 mV滿度一檔。跟著進行 「壹點校正」, 置準備好之 Sb/Cu 組合電極於 pH 7 緩衝溶液中,探頭輸出接上傳感器,旋轉 pH Cal 10K 可變電阻至 DMM 顯示 70 mV。「壹點校正」 完畢 (圖 130) ,可以開始實驗,測試任何水溶液之 pH 值。例如 Sb/Cu 組合電極放入 pH 5.5 溶液中,DMM 會顯示 55 mV (視作 pH 5.5) ,如此類推。總之,設計最後條件是傳感器於0 pH 時 輸出 0 mV而跟随之變化為 10 mV/ pH。

(圖130)「壹點」 pH 7 校正
(vii) 傳感器裝配
自製儀器之重要目的是以本地資源完成製作。前設是掌握有關課程 (1) 之各種手工和電子技巧。 課程 (1) 主題15 和課程 (1) 主題15列舉香港熱門電子零件,工具和物料集中地點,非常容易按資訊購買各類零件物料。香港是購物天堂,電子零件也不例外。一般電子零件價錢不跟通脹上升,反之随時間增長而下降。運算放大器IC一般只售十元左右 (2020年價格)。通用數字萬用錶 (DMM) 也很便宜,不用一佰港元。
整個傳感器線路耗電量很小,三顆 (CR 2032) 紐扣形鋰電池分別提供主線路電源和負參考電壓電源。用幾滴化膠水(trichloromethane) 把一PVC膠條黏貼三個紐扣形鋰電池座,兩個 (6V) 作LM 358 Vcc 和 Vee電源,一個 (3V) 作負參考電壓電源 (圖 132)。
按圖127 之線路完成焊接各款電子零件於萬用線路板上 (圖 131)。整個裝置放入一10 cm x 6 cm x 2.5 cm 儀器膠盒內 (圖132至133)。因零件盒細小,只靠接線和各組件佔據之空間互相靠攏,蓋上盒子蓋子便可把整體裝置固定下來,不用修螺絲,自身固定。
 |  |  |
| (圖131) 焊接電子零伴於萬用PCB上 | ( 圖132) 膠盒內部照像,3枚鈕扣形 鋰電池標籤為1,2和3 | (圖133) 完成品 |
銻電極 和 銅/銅(II) 參考電極之製造
(1) 銻電極
置金屬銻粉 (AR grade) 於坩堝內,於煙櫥內強力加熱至融化 (圖134) 。用移液管膠泵或針筒把融化銻緩緩吸上一小節玻璃小管。熾熱之液態銻在管內凝結,形成一條金屬銻小棒。之後弄碎玻璃管,把小金屬銻棒取出。銻棒很易斷裂,分成數節小銻棒。準備好之小銻棒焊接上一節供導電銅棒 (銻很易上錫)。除了前後兩端,其他部位都被雙層收縮膠箍死絕緣。完成製造銻電極 (圖135) 。 |
(圖134) 強力加熱坩堝內之銻粉 |
(2) 銅/銅(II) 參考電極
銅/銅(II) 參考電極製作如下:把一節銅棒和一小段玻璃管用混合膠封死,玻璃管內留一小隔間用來填滿用小滴管注入之1M硫酸銅溶液。一小節「鹽栓」代替傳統鹽橋。「鹽栓」是一小節木牙簽浸透飽和KNO3溶液跟著涼乾。參考 (圖120至121)。要注意一㸃是隔間內不容許小汽泡,否則電極導電程度不穩定 (圖137)。 |
(3) 完成之組合銻電極
(圖138) 完成之銻/銅 (II) 組合電極
檢視上圖可不用多解釋便明瞭組合銻電極之運作原理。組合銻電極可輕易放入24井穴板進行實驗。
實驗 (17):組合銻電極酸度計 「壹點校正」 (119頁)
實驗 (18):強酸vs強鹼滴定曲線 (0.1M HCl vs 0.1M NaOH) (121頁)
實驗 (19):弱酸vs強鹼滴定曲線 (0.1M CH3COOH vs 0.1M NaOH) (125頁)
(B) 基本模式
測量原理
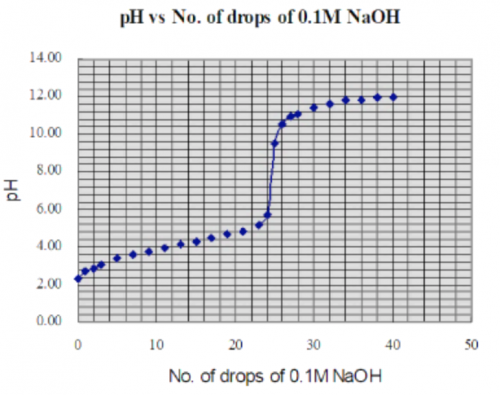
除了使用傳感器連接DMM測量pH,其實一個較簡單方法是不用傳感器,組合銻電極產生之訊號電壓直接輸入DMM。需要用另一種全 pH 校正方法。首先要用不同 pH 值 (2,4,7,10,13) 緩衝溶液建立一 pH 值校正圖 (圖139) 。
(圖139) 原e.m.f. vs pH 校正圖
(i) 延伸 (圖139) 直線至 pH 0 和 pH 14 得全 pH 值校正圖。若組合銻電極測量到0.14 V,從延伸圖可推斷 pH = 1.00,如此類推。
(ii) 借助電腦軟件MicroSoft Excel,建立 pH 校正直線回歸斜率。輸入電壓 = 0.14 V,可得 pH = 1.00
實驗 (20):組合銻電極酸度計基本校正和量度 pH (127頁)
5.2 微型電導計 (micro-scale conductance meter) 及建議實驗 (21) 和 (22)
初中和高中化學課程部有主題涉及溶液電導率,例如電解和電導滴定。有一點要特別注意:低壓直流電通過溶液會產生電解,分解電解液,不宜作定量分析溶液。溶液電導量化實驗一定要用交流電。
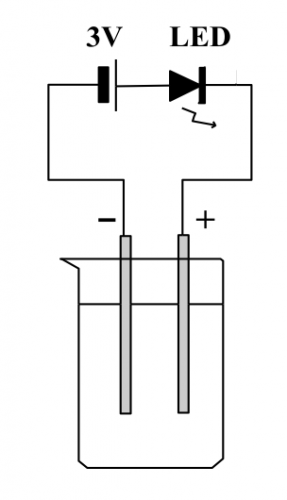
(圖140) LED 溶液電導裝置
很多中學化學溶液電導測試實驗都用上圖 LED 之光暗程度來顯示電解質溶液濃度之變化。這是一個又簡單又有效之裝置,對推廣初中學生參於實驗有幫助。不過,DSE 化學科課程有關溶液電導主題不僅需要定性分析,也需要定量測量,不可以量度時伴隨電解。顯然 (圖140) 裝置不符合DSE 化學科課程之要求。
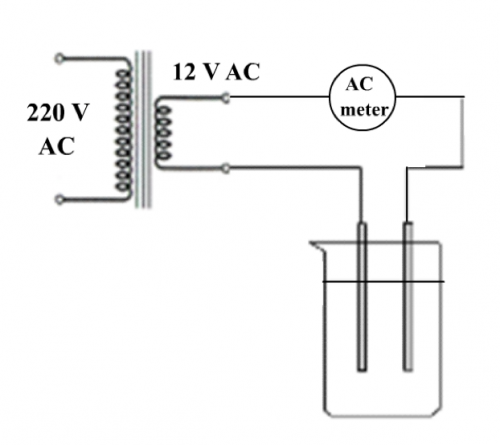
(圖141) 低壓交流電電導計
市電源經變壓器變為低壓交流電後才電導便不會產生電解,跟著設計一簡單電導計如 (圖 141) 所示 ,是一個可行的解決方法 。這方法 既傳統 ,不創新 ,也不方便。現時中學理科實驗室學生工作檯之低壓設備是直流電壓 ,不宜直接駁做電導實驗,要在電源外接低壓變壓器,操作不方便。
微型電導計之設計特式

(Fig. 142) 微型電導計
(i) 設計採用「DMM 顯示技巧」,以一廉價數字萬用錶 (DMM) ,數字顯示實驗最終結果。電子儀器採用這技巧十分適合中學定量化學實驗測量溶液pH值、溶液電導率和有色溶液吸光度。測量基本原理是這類探測器輸出之電源訊號,經過適當放大,可以配合一般數字萬用錶 (內阻不小於10 MΩ, 只耗用少量輸入電源) 作相當準確數字顯示。
(ii) 一般電導計儀器顯示單位為「mS/cm」。中學按課程授課不會解釋這單位意思。學生做實驗時面對這些儀器便有問題了。設計之電導計棄用單位概念。當探測器短路時 (即全電導) ,調校DMM 顯示 100 mV,完成電導計100 滿度校正 (沒有單位) 。若測量樣本溶液時顯示 34 mV,可視作樣本溶液之電導率為全電導之34/100 (圖 143) 。設計滿足「用家友善」條件,令儀器操作技巧不甚稱職之中學生也放心進行定量實驗。
(iii) 線路設計總輸出約500 mV,衰減至 385 mV (參閱54 頁)。滿度校正除定為 100 mV外,也可提升至 300 mV。這方法增加儀器準確度。舉個例:同條件下,若甪100 mV 滿度校正測得41 mV,甪300 mV 滿度校正則可顯示為124 mV,多一數位準繩。
(iv) 探測器導電時不可伴隨電解 (圖 164) ,因此需要AC電源。設計之傳感器有一弛張振盪電路,產生高频方波脈衝訊號鏈作導電電源 (圖 152) 。
(v) 傳感器後級採用電壓隨耦器 (voltage follower) 電路 (課程 (1) 主题3.1 72頁) 。此類緩衝性電路可消除雜訊和輸出低漂移電壓。

(圖143) 以微探測器、傳感器、24井穴板和DMM顯示溶液電導率為百分之29
儀器製作
(1) 電導探測器 (conductance probe)

(圖 144) 專業電導探測器
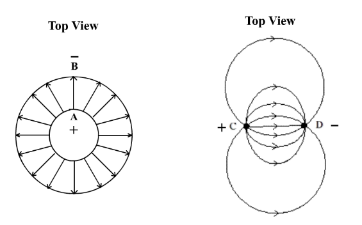
一般專業電導計探頭 (圖 144) 採用金屬同心圓柱筒作電導電極,因為電導時圓柱筒間之電塲線可平均垂直地分佈,滿足電導率線性計算之要求 (圖145)。經校正後,可計算樣本溶液電導率 (局限於特定溫度下低濃度。真實複雜數學定量考量涉及溶液全部可移動離子,包括相同極性和不同極性離子,網上搜尋)。專業電導計內置電子電路機制,以「mS/cm」單位顯示溶液電導率。課程 (2) 微型電導計之設計原意是自製,圓柱筒形探頭製作不簡單,不符合自製要求。
兩條絕緣發熱線棒 (nichrome wire) 可造成一個簡單平行電極電導探測器。發熱線棒C和 D之電場線分佈並不垂直,而是曲線形的 (圖146)。但這不重要,要點是電場分佈要有規律。(圖146) 發熱線棒 C和 D之電場符合這方面要求。若採用同專業電導計探頭校正方法是不可以計算溶液電導率。不過,圖表校正同計算校正一樣有效。非直線校正圖表也可計算溶液電導率。注意:導電不可伴隨電解,因此必需使用AC 電源,這也是傳感器設計一個主要目的。
| |
| (圖145) 圓柱A和B間之電場線平均垂直地分佈,符合電導率/濃度線性量化計算要求 | (圖146) 兩棒間之電場線有規律地作曲線形分佈。電導率/濃度圖解不呈直線,不可依公式計算。 |
平行式金屬棒條形電極製作不難。一式可放入96井穴板井穴之微型電導探頭可以如下步驟製作:
(a) 準備兩條長約13厘米硬度適中nichrome wire (即發熱線) 作電導電極。採用發熱線作電極是因為當發熱線通電至高温發紅隨著冷卻後會發現它返回原來樣子,沒有絲毫腐蝕。因此發熱線較其他金屬線條 (鉑除外) 更能抗拒腐蝕,更有惰性,尤其處於水或空氣中。
(b) 把其中一條發熱線用收縮膠加熱箍死絕緣,只露出兩端小部份作電導用。
(c) 另外一條發熱線不用處理,把這兩條發熱線同時放入一根大小10厘米長之玻璃管,管之兩端要突出電導部份。兩端用填料混合膠封死 (圖147)。不作探頭那端套上一節亞加力膠管,一個作用是使玻璃管不易斷裂,另一個作用只是為外觀。
(d) 亞加力膠管那端接上電纜導線作訊號輸出。要注意一點是發熱線不上錫,導線之銅線和發熱線要用收縮膠加熱箍死絕緣。有需要時用熱融膠整體包封。再用收縮膠加熱箍死玻璃管段完成製作 (圖148)
| (圖147) 電導探頭,大小與牙簽比較 | (圖148) 完成之電導探測器 |
(2) 傳感器 (The sensor)
組裝傳感器前置條件是掌握課程 (1) 陳述之手工和電子技巧。傳感器三大組成 (i) 一弛張振盪電路產生高頻訊號作為 AC 電源、(ii) 全波 AC 整流電路和 (iii) 一後級電壓隨隨耦器 (voltage follower) 電路輸出穩定電壓。整個流程如下圖所示:
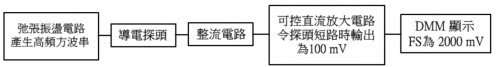
(圖149) 採用 「DMM 顯示」 技巧微型電導計流程圖
(i) 弛張振盪器
傳感器主部件是弛張振盪訊號產生器。設計採用「黑盒」處理方法,即着眼於輸入 / 輸出要求。手頭上有運算於放大器 IC、電容器和電阻,要組合產生一5000 Hz 方波訊號作AC電源。重温課程 (1) 主題 8.3.2 (e) 陳述之「弛張振盪器」,其標準電路如下圖所示:
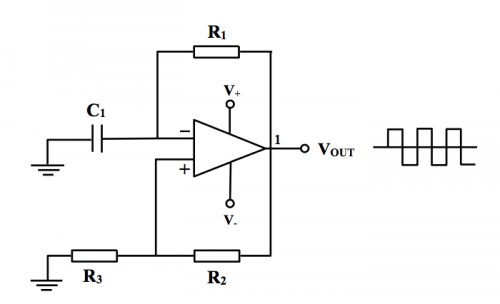
(圖 150) 標準弛張振盪器電路
計算弛張振盪器產生頻率之方程式為:
![]()
(ii) 傳感器電路
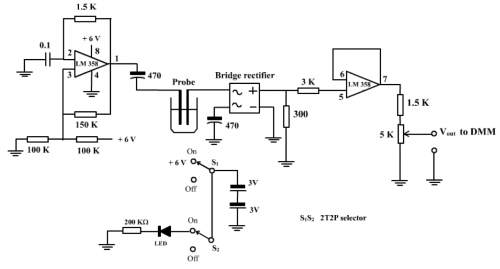
(圖151) 微型電導計傳感器線路圖
(iii) 電路工作原理
微型電導計傳感器線路工作原理可分三大部份考慮:
(a) 一組 LM 358 (第 1、2和3腳) 接駁成弛張振盪器,產生之方波頻率為:
![]()
代入C1、R1、R2 和R3 數據便可以計算頻率。 C1= 0.1mF,R1 = 1.5K, R2 = 150K, R3 = 100K, 計算之頻率為
![]()
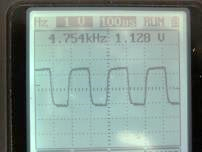
(圖152) 線路圖振盪器輸出之方波,因電阻數值誤差,顯示略少於 5 KHz
(b) 輸出方波交流電源通過探測器,經樣本溶液,全波整流改為只有上半波之直流。
(c) 整流後之直流電壓透過 3K電阻輸入接成電壓隨耦器 (voltage follower) 之另一組LM 358 (第5、6和7腳),輸出 1:1 電壓增值之穩定電壓。探測器短路時,7腳測得500 mV電壓輸出。經 1.5K 和 5K可變電阻串聯組合,於 5K 可變電阻抽取 0 至385 mV, [500 x 5/(1.5 + 5)]mV = 385 mV 。100、200 或300 滿度校正皆可由此輸出得以達致。方法是首先把探測器短路,調校5K可變電阻至DMM顯示100 mV或200 mV或300 mV便可。舉個例子:100滿度校正顯示 34 mV的樣本溶液電導率視作溶液之電導率為全電導之34/100。若選擇200滿度校正,DMM顯示 68 mV,也就是說靈敏度提高了。這種使用方法特顯無單位「DMM顯示技巧」之優越性。
(iv) 完整傳感器裝配
(a) 萬用印刷線路板和零件組合
差不多全部電子零件都可以焊接在一小塊萬用印刷線路板。焊接前先要準備好各零件之最合適位置。要伸出引線焊接其他線路板以外之零件如5K可變電阻,6V電源盒,開關,LED指示,輸入和輸出插座 (圖153,154)。
 |  |
(圖154) 完成焊接之萬用印刷線路板 (背面) |
(b) 6V 電源
4枚1.5V AAA電池置於電池座構成一個6V DC電源 (圖155)。
 |  |  |
| (圖155) 6V電池電源 | (圖156) 儀器工具盒 | (圖157) 盒面孔穴 |
(c) 儀器工具盒
整個傳感器裝置放入一個120 x 70 x 25 mm 塑膠專業儀器工具盒內 (圖156)。盒面適當位置鑽不同大小孔洞以安裝 5K可變電阻,照明指示LED和 探頭插座 (圖157)。盒低盤兩側一邊鑽一孔容納微型 push-on / push-off 開關,另一邊鑽一孔容納輸出用DC插座,接DMM (圖158)。
| (圖158) 盒底孔穴 | (圖159) 完成各孔穴工具盒 |
(d) 整體傳感器組裝
盒面裝上5K可變電阻並套上旋鈕。把焊接好之萬用印刷線路板電纜引線接上6V電池電源 ,LED,5K可變電阻,微型push-on / push-off開關,探頭插座,DC插座 。線路板和其他零件接線可整體放入工具儀器盒,自身固定 (圖 160)。
(圖160) 盒面背部和線路板連接線 |
「短路校正」步驟
首先選擇DMM 2000 mV 輸入。接上傳感器輸入和輸出。把一根金屬條將探頭短路。調校傳感器旋鈕至DMM顯示 100 (圖161)。旋鈕固定下來,不再旋轉,完成 100 滿度校正。也可以把探頭插短路 (圖162) 。
(圖161) 100滿度「短路校正」方法一

(圖162) 100滿度「短路校正」方法二
測試溶液電導率
若把探頭放入某電解溶液,DMM顯示34 mV,表示這溶液之電導率為全電導之34% (圖163)。觀察測試時探頭不產生任何電解作用 (圖164)。
| (圖163) 顯示溶液電導率為百分之34 | (圖164) 測試時探頭不產生電解 |
實驗 (21): 電解質溶液電導率探究 (134頁)
實驗 (22): 電導滴定 (141頁)
5.3 一台負擔得起、靈敏度高、穩定性強和工作友善之比色計 (colorimeter) 及建議實驗 (23)、(24)、(25)、和 (26)
引言
人類雙眼視覺可分辨物體距離和立體感 (對光波相位差敏感) 和有色液體顏色之深淺 (對光波波幅敏感) 。因此眼睛是一個優良天然比色計,不過雖然眼睛以定性分辨顏色分類 ,但是它只可以辨别有色液體顏色之深淺而不可以量化顏色光度程度,我們可以辨別一件綠色物體之綠色為相當深色,但不能標籤它的綠色是5度深或6度深 (如果有)。雖然如此,人們仍可以靠眼睛檢視法半定量測量有色溶液之濃度。
1. 目視法估量 KMnO4 溶液濃度
| 1. | 用移液管轉移10 cm3 4 x 10-3 M KMnO4入試管 (1) 。 |
| 2. | 從試管 (1) 移10 cm3入另一試管,加相同容量蒸餾水,攪拌好並標籤為試管 (2) 。 |
| 3. | 從試管 (2) 移10 cm3入另一試管,加相同容量蒸餾水,攪拌好並標籤為試管 (3) 。 |
| 4. | 重複步驟 (3) 4 次,從而準備試管 (5,6,7,8) 。下表列出各試管之溶液濃度: |
| 試管 | KMnO4 濃度 / x 10-4mol dm-3 |
| 1 | 40.00 |
| 2 | 20.00 |
| 3 | 10.00 |
| 4 | 5.00 |
| 5 | 2.5 |
| 6 | 1.25 |
| 7 | 0.625 |
| 8 | 0.3125 |
| 5. | 置 8 試管於一線排列,放入試管架或用透明膠貼黏在一起 (圖165)。 |
| 6. | 置末知濃度之KMnO4溶液 (溶液X) 接近排列。目視決定排列某試管顏色最接近溶液X。X之濃度便假定是某試管之濃度。 |
2. 比色計量度有色溶液濃度
以上之目視法可見人類眼睛就是一個天然的比色計 。方法雖然簡單 ,但卻帶出一個重要步驟,就是調校或校正。(圖162) 是一塊調校板,用實驗品對比一下可推測實驗品濃度 。視覺神經運作雖然極之神祕複雜 ,但作為傳感器,它只可以辨別顏色和深淺,沒有調校功能。量化有色溶液濃度需要人工儀器,那就是 比色計 。比色計原理和眼睛之視覺神經有㸃相似 ,不過以光敏電阻和電路作為傳感器記錄單色光源強度透過有色溶液之濃度變動令光敏電阻阻值改變作定量分析。比色計傳感器要經過調校後才可以運作,不可以一拿起就用
3. 一台負擔得起、靈敏度高、穩定性強和工作友善之比色計
a. 儀器設計特色
(i) 設計之比色計 (圖170) 採用「DMM顯示技巧」。用市面價廉之萬用數字電錶 (digital multi-meter, DMM) 作不同實驗終端顯示。這創新方法於主題5.1 和5.2已經論及,今次再次應用於測量有色溶液之吸光度。這款儀器就是常用之比色計 (colorimeter)。一如前兩款傳感器之設計理念,今次之比色計傳感器也控制電壓輸出為2000 mV以下,再微調输出從0 mV 至100 mV。只取其數字,即沒有單位,為實驗數據結果。
(ii) 一般比色計顯示單位為 「吸光度」 (absorbance) 或 「透光率」 (transmittance) 。「吸光度」 為一量化光強度單位,要知悉其相關對數方程式,即要懂比爾定律 (Beer’s law) 。高中化學科課程主題不常有,因為要做實驗而化時間講解單位 ,不如令數據不附帶單位 。「DMM顯示技巧」 正好符合這方面要求。這款比色計線路設計是溶液無顏色時 ,傳感器輸出為100 mV (圖 168) ,近全黑色時為 0 V (圖 169) 。若某有色溶液輸出為 66 mV (圖170) ,則這有色溶液之透光為無色百分之66 ,如此類推 。設計可為儀器操作流暢度稍遜之學生提供一個遷就用家或工作友善 (“user-friendly”) 工作環境。
(iii) 和一般中學比色計不同,設計不用試管而採用專業比色杯 (圖 166) 。
(iv) 傳統比色計採用 RGB 單色光濾光片 。實驗時要選擇適合之濾光片放入濾光片槽 ,產生單色光 。繼藍色 LED 普及後,三色 LED 發出之紅、綠、藍三色非常接近單色光,可以取代 RGB 單色光濾光片。因此這款比色計採用三色 LED 作光源 (圖 167) 。
| (圖166) 塑料比色杯和傳感器 | (圖167) RGB三色LED光源和比色杯槽 | (圖168) 空白樣本透光率 |
| (圖169) 近全黑透光率 | (圖170) 比色測量進行中 |
(B) 傳感器線路
(圖171) 比色計傳感器線路
(C) 電源
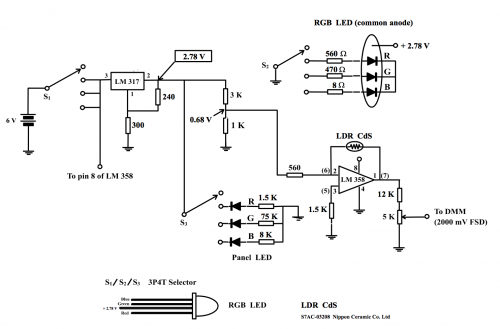
比色計電路電源不僅要供應 Op-Amp LM 358,也要供應三色 LED。後者需要較多電力,因此不宜用3 V鈕扣形薄電池,要用傳統電力較多之碳鋅 AAA電池。串聯 4 枚 AAA 電池得 6 V 作總電源電壓。三色 LED 光源要穩定才可以令傳感器電路輸出穩定,因此要用穩壓 IC 穩定電源 。線路採用可控穩壓IC LM 317 穩定電源電壓 。LM 317 要輸出低於 3 V之穩定電壓 ,免去燒毀 LED 風險。(圖 168) 240 Ω 和 300 Ω 電阻組合使 LM 317 輸出腳 (2) 電壓穏定於 + 2.78 V。 公式計算:![]()
但電阻數值誤差令輸出為2.78 V。LM 358電源不需要穩壓, 因為一般Op-Amp linear IC 對供應電源電壓都容許大程度之差別,在一定範圍內輸出都很稳定。
(D) 線路描述
(i) RGB LED 選擇單色光波長
用 3P4T 選擇器控制 (i) 電源開關,(ii) 選擇红色單色光 (主要 625 nm),(iii) 綠色單色光 (主要 520 nm) 或 藍色單色光 (主要 470 nm)。
(ii) Op-Amp LM 358 輸入
一組Op-Amp LM 358 (第1、2和3腳) 接成反相放大模式,第 2 腳接輸入訊號。預設輸入電壓為 + 0.7 V。穩壓器 LM 317 第 2 腳電壓為 2.78 V,輸出接一 3 K 和 1K 電阻串聯組合,抽頭和地可得 [2.78 x (1/4 )] V 或 0.7 V。但電阻串連接線路其他組成,抽頭處電壓測得0.61 V而不是0.7 V。因反相放大器輸入正壓而不是負壓,輸出電壓要計算多些而不是簡單的Vout = Vin ( R2/R1)。參考下段。
(iii) 電壓放大和光源調校
LDR CdS光敏電阻 (圖174) 是傳感器的核心零件。於綠色LED 光源下它的阻值約 3.5 KW,光源被遮擋下約 45 KW。反相放大電阻組合,即 560 W 和 LDR (R) 之電壓增益為 (R/560) ,換句話說,(i) 一般光源下增幅約 (-35000/560) 和 (ii) 黑環境下增幅約 (-45,000/560) 。即增幅範圍由約 (- 6) 至 (- 80)。 重溫課程(1) 主題8.3.2(b) 。
因 560 W 輸入電阻之輸入電壓不是負壓而是 + 0.68V,所以於LM 358 第 1 腳總輸出電壓要如以下計算:
基於計算電壓需要考慮「地」(即實質 0 V 或 6V 電源之負極) ,但是反相放大器相關計算之「地」並不是 0 V而是 LM 358 (-) 端或第 2 腳。這處視作「地」之電位差因此也稱作「虚地」 (virtual ground) 。基於這原因,第3腳, 即 (+) 端輸入,要產生與第 2 腳相同之電壓才可匹配2脚之「虚地」。 第 3 腳和實質地接一電阻 (偏置電阻,bias resistor) 便可糾正這一偏差,阻值計算如下:
![]()
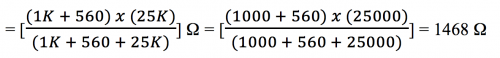
當被綠色單色光照射時, LDR 之電阻約 3.5 KΩ 而 560 Ω 電阻兩端測量之電位差為 0.047 V。這數值電壓放大至約 [(0.047) x (- 6)] V 或 – (~ 0.282) V。因此 LM 358 總輸出第 1 腳,透過560 Ω 和 5 KΩ,與 6 V 電源「地」之電位差為 (圖 172) :
第一腳輸出電壓 = [0.68 + (0.047) + (~ – 0.282)] V = ~ 0.445 V,即 ~ 445 mV。
由 5K 可變電阻控制之總輸出電壓幅度 = 0 V 至 [(445) x (5/17)] mV = 0 至 131 mV
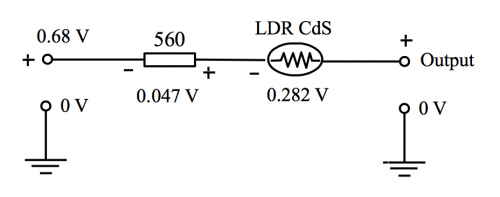
(Fig. 172) 反相放大電壓和相等極性線路
近全黑時, 輸入電壓為 0.738 V。LDR 之電阻约 45 K W ,而560 W 電阻兩端測量之電位差為 0.0089 V。這數值電壓放大至 ~ [(0.0089) x (- 80)] V 或 ~ – 0.712 V。因此 LM 358 總輸出第 1 腳和 6 V 電源「地」之電位差為 [0.738 + (0.0089 + (~ – 0712)] V = ~ 0.035 V,即 ~ 35 mV。
由 5K 可變電阻控制之總輸出電壓幅度 = 0 V 至 [(35) x (5/17)] mV = 0 至 10 mV
35 mV 至 445 mV 輸出範圍經 12K W 和 5K W 可變電阻可調校為0 – 100 mV 滿度顯示 (DMM 選擇 2000 mV FSD) 。換句話說 ,比色計若選擇綠色單色光 ,放入只盛載清水 (蒸餾水或去離子水) 之比色杯 ,再調校 5K W 可變電阻令 DMM 顯示 100 mV ,固定旋鈕位置便完成比色計對綠色單色光之校正了。
(iv) 電路評價
因全部訊號輸入都靠穩壓 IC LM 317 之輸出,所以全電路穩定性決定於光敏電阻 LDR 之質量。設計採用 Nippon Ceramic Co. Ltd. 生產之S7AC – 03208光敏電阻,靈敏度和穩定性良好。整體而言,設計之儀器有較高顯示複制性 (high display reproducibility) 和低數據漂移 (drift) 。LM 358 為一低壓單電源Op-Amp IC,設計之最低供壓 Vcc 為 3V。只要供壓不低於 4V,全線路供壓,包括經 LM 317 穩壓後供應 RGB 三色LED 之2.78 V電源和LM 358 第2 腳輸入之 + 0.7 V都非常穩定。若換了4枚全新AA電池 (1.5V @),儀器可長時間連續運作。
(E) 比色計原型製作詳情
(i) 塑料工具盒
全部組件收藏於一 (62 x 145 x 40) mm 面蓋連底座塑料工具盒。面蓋鑽不同大小孔洞 ,容納 (i) 3P4T 選擇器,(ii) 板面 RGB LED , (iii) 比色杯入口 ,(iv) 5K Ω 可變電阻和 (v) 輸出 DC 插座 (圖 170) 。
(ii) 電源和電池座
於底座適當位置用熱融膠黏實 4 位 AAA 電池座。放入 4 枚AA 鋅碳電池 (圖170) 。
 |  |  |
| (圖173) 工具盒和不同大小孔穴 | (圖174) 工具盒面、底和電池座 | (圖175) 藥水樽、蓋和一節頸部 |
(iii) 單色光光源
藍光 LED 近年才普及。市面出售之三色 (紅、綠和藍) LED 提供耗電量低 、易購買 、小巧 、價廉和接近單色光光源 。接上低於 DC 3 V 電源產生紅 (625 nm) 、綠 (520 nm) 和藍 (470 nm) 近似單色光光源, 遠較使用 RGB 三色濾光片為佳 。如一般 LED,RGB 三色 LED 對電源電壓承受幅度有限 ,不可高於 3V DC,否則會燒燬。
(iv) 比色杯艙
選擇一款 (60 cm3) 膠藥水樽 (或其他膠樽),樽口剛好套入一 (12.5 x 12.5 x 45) mm 比色杯 。弄掉藥水樽頂部 (圖 175),製成一個比色杯適配頭,再把這組合黏上蓋面之比色杯洞穴上。把四條亞加力膠條用化膠水黏貼成井字形 (圖176) 。這組合中心方形正好讓比色杯通過。把這井字組合黏貼蓋面底部 (圖 177) 。這個井字形組合比色杯艙可令比色杯安穩地從艙口放入。
| (圖176) 井字形組合 | (圖177) 井字形組合黏貼蓋面 | (圖178) U形黑色亞加力膠座和三色LED加LDR組合 |
(v) 三色 LED光源和 LDR接受座
用化膠水把三塊厚身黑色亞加力膠板條牢固黏貼,形成一U 形座。U 座之兩相對垂直圍牆各鑽一孔安放三色 LED 和 LDR,三色 LED 對準LDR。適當位置用強力黏合劑把 U 座黏緊工具底座,形成一完整比色杯艙 (圖 178)。比色杯放入杯艙後不容許絲毫移動,否則 DMM 顯示會不穩定 (圖 179)。
(圖179) 亞加力膠艙配合比色杯組裝 | (圖180) 萬用線路板佈局 | (圖181) 焊接萬用線路板和比色計底座分離展示 |
(vi) 零件安排布置和線路焊接
整個線路 (圖 171) 可焊接於一塊萬用線路板上 (圖 180) 。考慮安排佈線時要顧及簡易維修度 。如此,萬用線路板和工具盒面便可輕易拆卸,離開底座 (圖 181) ,方便維修 。設計風格各人不同,不過方便程度是主要考慮。最後一點提醒,零件間接口日久會鬆弛或甩脫,失去接觸,引致電路失靈。補救方法可用熱融膠或絕緣噴劑封閉接口。
以任何商業形式再製造網頁各項設計皆視作侵犯微型化學實驗室版權。
(F) 準備實驗
(i) 儀器校正
儀器校正就是每次實驗前之 DMM 顯示滿度 (100 mV) 校正。
選擇單色光
開啟傳感器和DMM並選擇 DC 2000 mV FS ,連接感器和DMM 。比色杯裝約 3/4滿去離子水,放入比色杯艙 (比色杯艙兩光滑面要分别面向RGB LED 和 LDR),蓋好蓋子。旋轉 3P4T選擇器選擇紅LED,調校 5K Ω 可變電阻至顯示 100 mV。
移走去離子水,注入 同一 比色杯3/4滿樣本溶液。記錄DMM讀數,例如 85mV。選擇另一單色光,例如綠色 LED並記錄DMM讀。剩餘之藍色LED重覆上述步驟。決定那單色光源少於或等於 85 mV。這單色光源就是要選擇之光源。棕色或紫色溶液要用綠單色光。
確定滿度校正
選擇已確定之單色光源。置一內注3/4 滿去離子水比色杯於比色杯艙。調校5K Ω 可電阻變阻至 DMM 顯示 100 mV (圖 182) 。移去比色杯,用不透明物件阻擋光源並記錄比色計於近全黑環境下之 DMM 讀數 (圖 183) 。
(ii) 測量吸光度
經校正後,固定儀器之5K Ω 可變電阻位置。比色杯注入3/4 滿樣本有色溶液,放返比色杯艙。等候至讀數穩定並記錄數據。若DMM顯示 66 mV,可視作溶液對選擇單色光之吸光率為 66% (圖 184) 。
| (圖182) 空白測試 | (圖183) 阻塞光源測試 | (圖184) 76% 透光率 |
實驗 (23): 定量測定高錳酸鉀 (KMnO4) 濃度 (146頁)
實驗 (24): 測定不含酒精飲料的食物色素的含量 (154頁)
實驗 (25): 強鹼溶液酚酞退色反應級數 (159頁)
實驗 (26): 酸性溶液過氧化離子氧化碘離子之反應級數 (166頁)