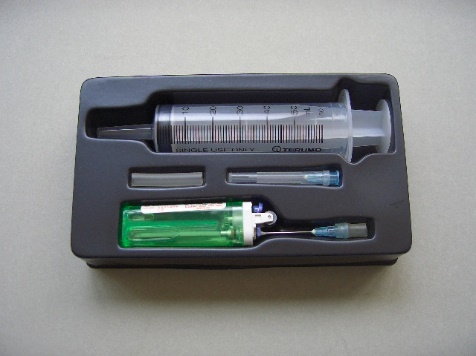
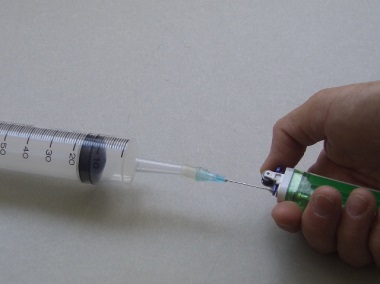
實驗 (1) : 製備2-氯-2-甲基丙烷
(i) 實驗目的
從2-甲基丙-2-醇和濃氫氯酸製備2-氯-2-甲基丙烷及測定其百分產率。
(ii) 安全措施
應在通風良好的實驗室內進行此實驗。為了避免引發哮喘病,學生患有慢性呼吸氣道疾病絕不應吸入氣體。佩戴安全措施眼鏡。避免讓皮膚沾上化學品。 有關實驗使用之化學物品資料可參考Material Safety Data Sheet (MSDS)。 |
|
(iii) 試劑和儀器
| 試劑 | 數量 | 儀器 | 數量 |
| ** 濃氫氯酸 | 5 cm3 | 冷凍「凍棒」 | 1 |
| * 2-甲基丙-2-醇 | 5 cm3 | 微型低壓加熱器 | 1 |
| 「餾液杯」 | 1 | ||
| 鐵架及鐵夾 | 1 | ||
| 10 cm3量筒 | 1 | ||
| 微型膠滴管 (或3 cm3針筒) | 1 | ||
| 塑膠移液管 | 1 | ||
| 微型刮勺 | 1 | ||
| 電子天秤 (± 0.01g) | 1 | ||
| 漰沸小粒 | 少量 | ||
| 針形數字溫度計 | 1 | ||
* **
**
(iv) 實驗步驟
1. 置280克2-甲基丙-2-醇 (一般為液態,熔點 = 26oC) 於一試管內。
2. 利用塑膠移液管,加入約2毫升濃氫氯酸。同時加入少許防漰沸小粒。
3. 把試管放入微型低壓加熱器之電阻組內。接上12V電源。夾緊 「凍棒」,並放入試管內。下降 「凍棒」 直至黃銅棒的一端高於反應混合物溶液約1釐米。回流10分鐘 (圖 31,第12頁)。
4. 移去 「凍棒」,把黃銅棒的一端套上 「餾液杯」。再次放入試管內和開始蒸餾 (圖 185)。
5. 等候獲取適量餾液。用微型膠滴管或針筒移餾液至一已稱量之小試管。
6. 重複步驟 (5) 二或三次,視乎收集到餾液之體積。
7. 測定餾液之質量。
8. 利用 ”針形” 數位溫度計和 「凍環」去測定餾液之沸點 (圖 33,第 12 頁)。
(v) 實驗結果
![]()
餾液 (2-氯-2-甲基丙烷) 質量= 0.143克
用去2-甲基丙-2-醇之摩尓數 = 0.28/74 = 0.00378
生成2-氯-2-甲基丙烷之摩尓數 = 0.143/92.6 = 0.00154
2-氯-2-甲基丙烷百分比產率 = (0.00154/0.00378) x 100 = 40.7%
製備2-氯-2-甲基丙烷之沸點 = 51.0oC (文獻數據:50.8oC)
(圖185) 微型蒸餾
(vi) 總結
由2-甲基丙-2-醇和濃氫氯酸製備之2-氯-2-甲基丙烷百分產率測定為40.7%。沸點檢視產物相當純正。
(vii) 增潤
從短片 製備2-氯-2-甲基丙烷 可見2-氯-2-甲基丙烷不溶於水溶液而密度也低於水,所以浮在回流後之産物上。一快捷方法是不用蒸餾杯微型蒸餾法收集上層之餾液而是用針筒針咀直接吸取上層之2-氯-2-甲基丙烷產物。
製備2-氯-2-甲基丙烷
實驗 (2) : 製備甲酸乙酯
酯製備選擇
以濃硫酸為催化劑,烷醇和烷酸反應生成酯。下表 (圖 186) 列出低分子量酯沸點:
低分子量酯製備 | ||
乙酸乙酯 | Equation: | C2H5OH + CH3COOH |
B. Pt.: | 78 oC 118 oC 77 oC 100 oC | |
甲酸乙酯 | Equation: | C2H5OH + HCOOH |
B. Pt.: | 78 oC 101 oC 54 oC 100 oC | |
甲酸甲酯 | Equation: | CH3OH + HCOOH |
B. Pt.: | 65 oC 101oC 32 oC 100 oC | |
乙酸甲酯 | Equation: | CH3OH + CH3COOH |
B. Pt.: | 65 oC 118 oC 57 oC 100 oC | |
(Fig. 186) 低分子量酯製備和沸點
中學化學有機實驗多採用製備乙酸乙酯作為酯主題之學生實驗。不過,若檢視圖 183 之各酯類沸點,發現產物乙酸乙酯之沸點 (77oC) 和反應物乙醇之沸點 (78oC) 非常接近,不利即時把回流步驟改為蒸餾步驟,因餾液不會是純產物乙酸乙酯而是大比例伴隨反應物乙醇,導致產率甚低。
選擇沸點低產物為生成酯顯然是個好主意 。考慮到甲酸乙酯之沸點只有 54oC,明顯地低於反應物乙醇 (78oC) 、甲酸 (101oC) 和另一產物水分子 (100oC) 。因此選擇甲酸和乙醇之酯化反應遠較乙酸和乙醇之酯化反應為好。再者,甲酸甲酯沸點太低 (32oC),不宜製備。
(i) 實驗目的
從甲酸和乙醇酯化反應卒取甲酸乙酯並測定百分率純度。
(ii) 安全措施
應在通風良好的實驗室內進行此實驗。為了避免引發哮喘病,學生患有慢性呼吸氣道疾病絕不應吸入氣體。佩戴安全措施眼鏡。避免讓皮膚沾上化學品。 有關實驗使用之化學物品資料可參考Material Safety Data Sheet (MSDS)。 |
|
(iii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
** 濃硫酸 (強刺激性) | 3 drops | 冷凍「凍棒」 | 1 |
* 甲酸 | 5 cm3 | 微型低壓加熱器 | 1 |
乙醇 | 5 cm3 | 「餾液杯」 | 1 |
| 試管 | 1 | |
| 小試管 | 1 | ||
| 鐵架及鐵夾 | 1 | ||
| 10 cm3量筒 | 1 | ||
| 微型膠滴管 (或3 cm3針筒) | 1 | ||
| 塑膠移液管 | 1 | ||
| 10 cm3量筒 | 1 | ||
| 微型刮勺 | 1 | ||
| 電子天秤 (± 0.01g) | 1 | ||
| 漰沸小粒 | 少量 | ||
| 針形T數字溫度計 | 1 | ||
* **
**
(iv) 實驗步驟
1. | 利用塑膠移液管,置40滴乙醇和60滴甲酸於一試管內。跟著加入3滴濃硫酸。最後放入少許防漰沸小粒。 |
2. | 把試管放入微型低壓加熱器之電阻井形組合內。接上12V電源。夾緊 「凍棒」,並放入試管內。下降 「凍棒」 直至黃銅棒的一端高於反應混合物溶液約1釐米。回流30分鐘。 |
3. | 移離「凍棒」,接著套上「餾液杯」,轉回流裝置為蒸餾裝置。蒸餾至「餾液杯」滿載。移出「凍棒」組合。用微型塑膠移液管或針筒吸取「餾液杯」 內所有之餾液,移至一小試管並測定其沸點。 |
(v) 實驗結果
蒸餾產物沸點 = 54.0oC
(文獻數據:甲酸乙酯沸點 = 54.0oC)
(vi) 總結
進行了微型蒸餾製備甲酸乙酯實驗。產物測定為純甲酸乙酯。
(vii) 備註
這套微型蒸餾裝置對小規模有機反應非常有效。不採用自來水冷卻不但可節省水源,整個設計可啟發學生對環境保護認知,加強「綠色意識」。設備既可縮短裝置時間,其無火加熱方法也令實驗更安全措施。元件用活性頗低之銅和黃銅製造,腐蝕程度不大。金屬長時間和有機溶液接觸會產生鈍性,不再腐蝕。
裝置非常適用於對沸點低於100oC之有機產物。加大微型加熱器之電流可增加發熱器之溫度,可用于沸點高於100oC之有機產物。若回流少於一小時,「凍棒」 可預先放入電冰箱下格。如果放入上格 (冰格),冷卻之 「凍棒」 可維持回流三小時。
酯化反應是可逆反應。甲酸乙酯溶解度為9%。回流後接着蒸餾不是個好方法製備酯。此實驗旨在獲取產物酯和測定其純度,不是求百分產率。
(vi) 網頁搜尋
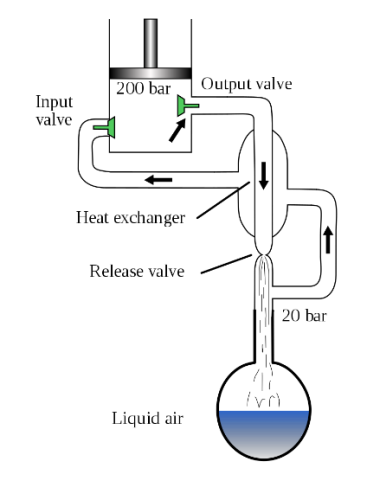
大自然有豐厚氧氣儲備。獲取大自然氧氣是用蒸餾法。首先是把空氣變為液態空氣,然後蒸餾得氧氣。試從網頁尋找如何把空氣液化,基於什麼理論?又如何提取氧氣?
液化空氣基於焦耳–湯姆孫效應(Joule-Thomson effect):當氣體膨脹,分子之間的平均距離上升。因為分子間吸引力,氣體的位能上升。因為這是等焓 (絕熱) 過程,系統的總能量守恆,所以位能上升必然會令動能下降,故此溫度下降。
威廉漢普遜和卡爾·馮林德基於焦耳–湯姆孫效應設計了第一套設施冷卻空氣至其液態化。
冷卻循環工作突要點:
|
液態氧之沸點為 – 183oC,液態氮之沸點為 −196 °C。分餾可獨立分離兩者。
「反應碟」實驗
目的:按下列每項作微型測試二氧化硫、氯和氨氣:
(i) 酸/鹽特性
(ii) 氧化/還原特性
(iii) 沉澱之形成
(iv) 絡離子之產生
實驗 (3) : 測試二氧化硫之酸性和還原反應
(i) 實驗目的
用「反應碟」同時進行四個測試二氧化硫之酸性和還原反應實驗。
(ii) 安全措施
生成之二氧化硫有毒,切勿在実驗過程中直接嗅聞,並應在通風良好的實驗室內進行此実驗。為了避免引發哮喘病,學生患有慢性呼吸氣道疾病絕不應吸入氣體。避免讓皮膚沾上化學品 有關實驗使用之化學物品資料可參考Material Safety Data Sheet (MSDS)。 |
|
(iii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
| *2 M H2SO4(aq) | 5 cm3 | 「反應碟」 | 1 |
| 0.02 M KMnO4(aq) | 5 cm3 | 白瓷磚或白紙 | 1 |
| 0.2 M K2Cr2O7(aq) | 5 cm3 | Combo井穴板 | 1 |
| 碘溶液 | 5 cm3 | 放大鏡 | 1 |
| 固體硫代硫酸鈉 | 0.5g | 微型膠滴管 | 4 |
| 通用指示劑 | 1 cm3 | 塑膠移液管 | 4 |
| 去離子水 | 10 cm3 | 微型刮勺 | 1 |
| 50 cm3 燒杯 (清洗用) | 1 | |
*
(iv) 實驗步驟
| 1. | 置二小粒硫代硫酸鈉晶體於「反應碟」之中央井穴。 |
| 2. | 製備稀KMnO4溶液如下:利用一微型膠滴管,加1滴酸化0.02 M KMnO4(aq)入孔井於Combo井穴板之大井穴內。用塑膠移液管加入40滴去離子水並用微型刮勺攪拌。移取10小滴至「反應碟」其中一個周邊井穴。 |
| 3. | 製備稀K2Cr2O7溶液如下:利用一微型膠滴管,加3滴酸化0.2 M K2Cr2O7(aq)入孔井於Combo井穴板之大井穴內。用塑膠移液管加入20滴去離子水並用微型刮勺攪拌。移取10小滴至「反應碟」其中一個周邊井穴。 |
| 4. | 製備稀通用指示劑溶液如下:加3小滴通用指示劑溶液入「反應碟」其中一個周邊井穴,跟著加7小滴去離子水。 |
| 5. | 製備碘溶液如下:加10小滴碘溶液入「反應碟」其中一個周邊井穴。 |
| 6. | 利用塑膠移液管 ,加8滴2 M H2SO4(aq)入「反應碟」之中央井穴 。置「反應碟」于一皮氏培養皿內 ,蓋上上蓋 。置整個組合於白瓷磚上或亮之燈箱上。用一面放大鏡觀察。 |
| 7. | 實驗完畢後,「反應碟」之各井穴都要用棉花棒和小量清潔劑洗滌。 |
(v) 實驗結果
完成下表:
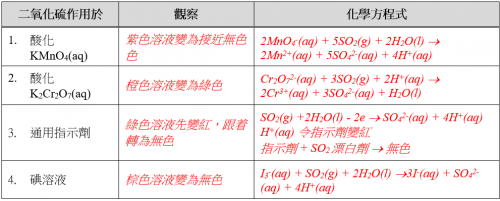
(vi) 思考題
試從實驗結果推斷二氧化硫之化學特性。
二氧化硫氣體溶於水呈酸。二氧化硫水溶液接收電子,為還原劑。二氧化硫水溶液也是一款漂白劑。
實驗 (4):測試氯氣之酸性,漂白和氧化反應
(i) 實驗目的
用「反應碟」同時進行四個測試氯氣酸性和還原反應實驗
(ii) 安全措施
生成之氯氣有劇毒和強烈刺激性。切勿在實驗過程中直接嗅聞,並應通風良好的實驗室內進行此実驗。為了避免引發哮喘病,學生患有慢性呼吸氣道疾病絕不應吸入氣體。避免讓皮膚沾上化學品。 |
|
有關實驗使用之化學物品資料可參考Material Safety Data Sheet (MSDS)。
(iii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
| * 2 M H2SO4(aq) | 5 cm3 | 「反應碟」 | 1 |
| * 漂白水 (bleach) | 放大鏡鏡5 cm3 | 白瓷磚或白紙 | 1 |
| 0.6 M KI(aq) | 5 cm3 | Combo井穴板 | 1 |
| 0.5 M FeSO4(aq) | 5 cm3 | 放大鏡 | 1 |
| 0.02 M KMnO4(aq) | 5 cm3 | 微型膠滴管 | 4 |
| 通用指示劑 | 1 cm3 | 塑膠移液管 | 4 |
| 去離子水, | 10 cm3 | 微型刮勺 | 1 |
| 50 cm3 燒杯 (清洗用) | 1 | |
**
(iv) Experimental procedures
| 1. | 置3大滴漂白水於「反應碟」中央之井穴。 |
| 2. | 製備稀KMnO4溶液如下:利用一微型膠滴管,加1滴酸化02 M KMnO4(aq) 入Combo井穴板之大井穴內 。用塑膠移液管加入40滴去離子水並用微型刮勺攪拌 。移 取10小滴至「反應碟」其中一個周邊井穴。 |
| 3. | 製備稀通用指示劑溶液如下:加3小滴通用指示劑溶液入「反應碟」其中一個周邊井穴,跟著加7小滴去離子水。 |
| 4. | 製備KI(aq) 溶液如下:加10小滴6 M KI(aq) 溶液入「反應碟」其中一個周邊井穴。 |
| 5. | 製備FeSO4(aq) 溶液如下:加10小滴5 M FeSO4(aq ) 溶液入「反應碟」其中一個周邊井穴。 |
| 6. | 利用塑膠移液管 ,加7滴2 M H2SO4(aq)入「反應碟」之中央井穴 。置「反應碟」于一皮氏培養皿內,蓋上上蓋 。放整個組合於白瓷磚上或照亮之燈箱上。用一面放大鏡觀察。 |
| 7. | 實驗完畢後,「反應碟」之各井穴都要用棉花棒和小量清潔劑洗滌。 |
(v) 實驗結果
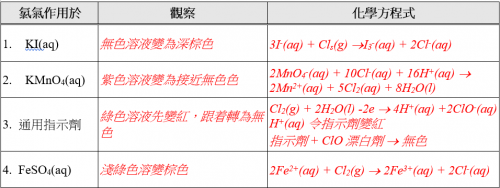
(vi) 思考題
試從實驗結果推斷氯之化學特性。
氯氣溶於水呈酸性。氯氣水溶液供應電子,為氧化劑。氯氣水溶液也是一款漂白劑
實驗 (5):測試氨氣之鹼性,氧化反應和沉澱反應 (增潤:絡離子,complex ions)
(i) 實驗目的
用「反應碟」同時進行六個測試氨氣之鹼性,氧化反應和沉澱反應實驗
(ii) 安全措施
氨氣有毒和強烈刺激性。切勿在實驗過程中直接嗅聞,並應在通風良好的實驗室內進行此実驗。為了避免引發哮喘病,學生患有慢性呼吸氣道疾病絕不應吸入氣體。避免讓皮膚沾上化學品。 有關實驗使用之化學物品資料可參考Material Safety Data Sheet (MSDS) |
|
(iii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
| **濃氨水 | 5 cm3 | 「反應碟」 | 1 |
| 0.5 M ZnSO4 | 5 cm3 | 白瓷磚或白紙 | 1 |
| 0.5 M AgNO | 5 cm3 | Combo井穴板 | 1 |
| 0.5 M FeSO4 | 5 cm3 | 放大鏡 | 1 |
| 0.5 M Fe(NO3)3 | 5 cm3 | 微型膠滴管 | 6 |
| 1 M CuSO4 | 1 cm3 | 塑膠移液管 | 6 |
| 通用指示劑 | 1 cm3 | 微型刮勺 | 1 |
| 去離子水 | 10 cm3 | 50 cm3 燒杯 (清洗用) | 1 |
** 
(iv) 實驗步驟
| 1. | 製備稀ZnSO4(aq) 溶液如下 :加1小滴0.5 M ZnSO4(aq)入「反應碟」其中一個周邊井穴,跟著加9小滴去離子水。 |
| 2. | 製備稀CuSO4(aq) 溶液如下 :加1小滴1 M CuSO4(aq)入「反應碟」其中一個周邊井穴,跟著加9小滴去離子水。 |
| 3. | 製備稀AgNO3(aq) 溶液如下:加1小滴0.5 M AgNO3(aq)入「反應碟」其中一個周邊井穴,跟著加9小滴去離子水。 |
| 4. | 製備稀FeSO4(aq) 溶液如下 :加1小滴0.5 M FeSO4(aq)入「反應碟」其中一個周邊井穴,跟著加9小滴去離子水。 |
| 5. | 製備稀Fe(NO3)3溶液如下 :加1小滴0.5 Fe(NO3)3入「反應碟」其中一個周邊井穴,跟著加9小滴去離子水。 |
| 6. | 製備稀通用指示劑溶液如下 :加1小滴通用指示劑溶液入「反應碟」其中一個周邊井穴,跟著加9小滴去離子水。 |
| 7. | 煙廚內置8大滴濃氨水於「反應碟」中央之井穴。安放「反應碟」于一皮氏培養皿內,蓋上上蓋。置整個組合於白瓷磚上或照亮之燈箱上。用一面放大鏡觀察。 |
| 8. | 實驗完畢後,「反應碟」之各井穴都要用棉花棒和小量清潔劑洗滌。 |
(v) 實驗結果
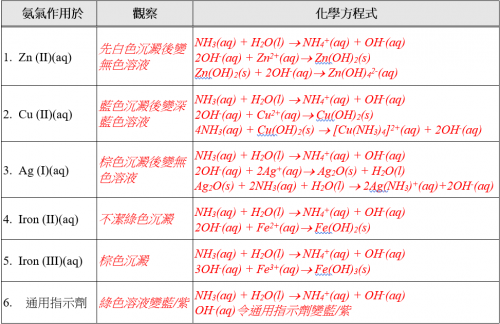
(vi) 思考題
試從實驗結果推斷氨之化學特性。氨氣溶於水呈鹼性。氨溶液為沉澱剂,也和 Zn2+(aq) 或 Ag+(aq) 生成絡離子。
實驗 (6) : 分餾紫色酒精 (增潤實驗)
蒸氣壓和分餾
(DSE課程沒有理想溶液和蒸氣壓主題,可視為有關石油分餾和分析化學課題之增潤資料)
(i) 實驗目的
1. 製作理想溶液(甲醇/水)沸點/組成百分比圖
2. 進行工業木精微型蒸餾
(ii) 理論和引入
因溶劑/溶劑、溶質/溶質和溶質/溶劑分子間之相若引力導致理想溶液之蒸氣壓和組成百分比有線性關係(圖187)。一般來說,較易揮發組成(即沸點較低的)有較高之蒸氣壓。當理想溶液沸騰時,溶液和上面蒸氣之溫度並不一樣。因蒸氣內有較多易揮發組成,所以蒸氣溫度較溶液溫度低一些。因為這個原因,沸點和組成百分比作圖並不成一直線,液態曲線在下面而蒸氣曲線在上面 (圖187)和 (圖185)。
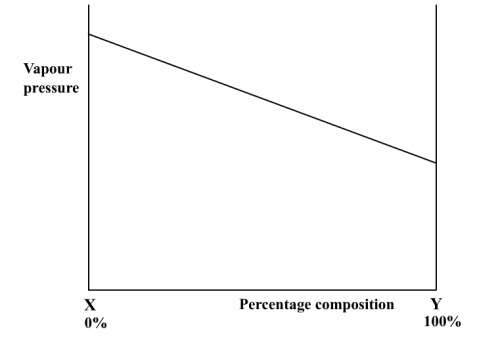 | 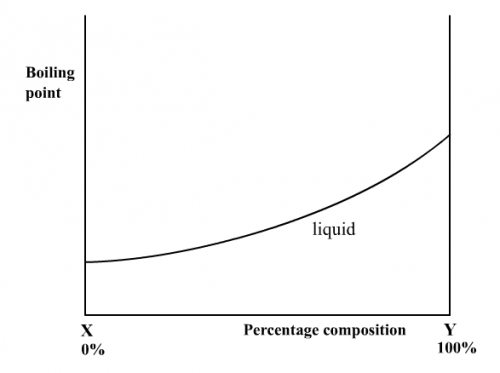 |
(圖187) 蒸氣壓/組成百分比圖 | (圖188) 沸點/組成百分比圖 |
理想溶液進行第一次蒸餾時,生成之蒸氣有較多之易揮發組成。當這份蒸氣冷卻後再蒸餾時(第二次蒸餾),再次生成之蒸氣會有更多之易揮發組成(圖189)。
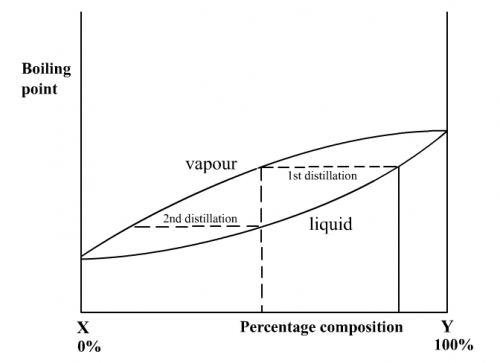
(圖189) 完全沸點/組成百分比圖
實驗之甲醇/水混合物為一理想溶液。.
(iii) 安全措施
佩帶安全措施眼鏡,避免化學物品接觸皮膚,使用最少的所需藥品,在老師的指示下棄置化學廢料及多餘藥品。 有關實驗使用之化學物品資料可參考Material Safety Data Sheet (MSDS)。 |
|
(iv) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
| 工業用紫色木精 | 10 cm3 | 微型分餾儀器 | 1 |
| 甲醇 | 10 cm3 | 試管 | 1 |
| 蒸餾水/去離子水 | 適量 | 試管架 | 1 |
| 防漰沸小粒 | 1g | 250 cm3 燒杯 | 1 |
| 膠滴管 | 1 | |
| 內有蒸餾水之洗滌瓶 | 1 | ||
| 數字溫度計(-50至150)oC | 1 | ||
(v) 實驗步驟
(A) 甲醇/水混合物之沸點/組成百分比圖
1. 置20滴甲醇於一小試管並放入少許防漰沸小粒。用熱水浴測試甲醇之沸點。
2. 用水代替甲醇,用本生燈加熱至熱水浴沸點。
3. 按以下表格之混合方法,測試每次甲醇/水混合物之沸點。
4. 每一甲醇/水混合物之沸點和組成百分比作圖。若以X為甲醇而Y為水,則所作之圖應像 (圖184)。.
小試管 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 甲醇滴數 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 蒸餾水滴數 | 18 | 16 | 14 | 12 | 10 | 8 | 6 | 4 | 2 |
(B) 紫色工業木精之微型蒸餾
1. 測定紫色工業木精樣本之沸點。
2. 依 (圖191) 裝備微型分餾柱。置約5 cm3木精樣本於小錐形瓶並加入少許防漰小粒。
 |  |  |
| (圖190) 微型分餾柱 | (圖191) 微型分餾柱 | (圖192) 裝置照片 |
 |  |
| (圖193) DMM/熱敏電阻/溫度測定 | (圖194) 分餾柱內反覆蒸發/凝結 |
3. 置準備好之裝置於水浴或砂浴。等候至沸騰並延遲些少時間達致熱平衡。測定微型分餾柱頂部液體之沸點。
(vi) 實驗結果
甲醇/水混合物之沸點/組成百分比圖
甲醇沸點 = 65oC
水沸點 = 100 oC
小試管 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
組成百分比 | 甲醇 | |||||||||
水 | ||||||||||
沸點 /oC | ||||||||||
沸點/組成百分比圖:

紫色工業木精之微型蒸餾
紫色木精樣本之沸點 = ____________ oC
微型分餾柱頂液體之沸點 = ______________ oC
(vii) 討論
1. 為什麼沸點/組成百分比圖不是一直線圖?
因為溶液之組成和由溶液生成蒸氣之組成並不一樣。
2. 試闡釋分餾柱長度和分離組成效能之關係。
分餾柱越長,組成分離越好。
3. 若不停地移走凝結在分餾柱頂部之液體,留在錐形瓶裏將會是甚麼?
水
4. 如何改良實驗裝置令沸騰平穩些?
小錐形瓶改為小試管
5. 除提鍊原油外,另列一利用分餾原理作工業用途之名稱。
液化空氣之分餾,生產液化氧和液化氮
(viii) 網頁搜索
連上互聯網並搜索有關以下題目之資料:
蒸發潛熱
(i) 為什麼沸騰時溫度不變?
因為提供之熱能全部轉為蒸發潛熱,沒有餘熱令溶液升溫。
(ii) 簡釋為什麼蒸發汗水可帶走人體過量熱能.
蒸發需要克服蒸發潛熱。在外面加熱情況下,人體體溫上升,随之流汗。蒸發汗水需要之潛熱帶走人體過量熱能而令身體而降溫,保持原有體溫。
(ix) 總結
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
實驗 (7) : 測試二氧化碳氣體
(i) 實驗目的
用「S」管 (圖 195) 測試二氧化碳氣體
(ii) 安全措施
配戴安全眼鏡,避免接觸化學品,盡量使用最少量的化學品,遵循老師的指示棄置化學物品。 |
|
(iii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
| *1M HCl(aq) | 10 cm3 | 「S」 管 | 1 |
| CaCO3(s) | 1 g | 試管 | 1 |
| 石灰水試劑溶液 | 5 cm3 | 試管架 | 1 |
| 去離子水 | 適量 | 試管木夾 | 1 |
| 防漰沸小粒 | 0.5g | 膠滴管 | 1 |
| 內有去離子水之洗滌瓶 | 1 | ||
| 250 cm3 燒杯 | 1 | ||
| 刮勺 | 1 | ||
*
(iv) 實驗步驟
1. 置小許石灰水試劑溶液於 「S」 管 ‘U’ 形部份。用刮勺放小量固態碳酸鈣入試管,移約20滴1M 鹽酸。把 「S」 管內裝石灰水試劑套上試管,試管底平均加熱至氣體釋放。小心觀察。反應產生之氣體進入石灰水只會進入小球但不會溢出。若停止加熱,冷卻後空氣「返吸」使石灰水只可以進入另外小球,而不會進入仍然處於高溫之試管,消除「返吸現象」。
觀察:石灰水很快變乳白色。
2. 若產生之氧體令石灰水變色後繼續進行實驗,最後會有什麼觀察?試以一化學方程簡釋之。
觀察:石灰水最後變回無色。
CaCO3(s) + 2HCl(aq) → CO2(g) + CaCl2(aq) + H2O(l)
CO2(g) + Ca(OH)2(aq) → CaCO3(s) + H2O(l)
白色沉澱
CaCO3(s) + CO2(g) + H2O(l) → Ca(HCO3)2(aq)
無色溶液
實驗 (8) : 測試二氧化硫氣體
(i) 實驗目的
用 「S」 管測試二氧化硫氣體
(ii) 安全措施
生成之二氧化硫有毒,切勿在実驗過程中直接嗅聞,並應在通風良好的實驗室內進行此実驗。為了避免引發哮喘病,學生患有慢性呼吸氣道疾病絕不應吸入氣體。避免讓皮膚沾上化學品。有關實驗使用之化學物品資料可參考Material Safety Data Sheet (MSDS)。 |
|
(iii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
| *1M H2SO4(aq) | 10 cm3 | 「S」 管 | 1 |
| 固態亞硫酸鈉 | 1 g | 試管 | 1 |
| K高錳酸鉀測試劑 | 5 cm3 | 試管架 | 1 |
| 防漰沸小粒 | 0.5g | 試管木夾 | 1 |
| 蒸餾水/去離子水 | 適量 | 膠滴管 | 1 |
| 內有蒸餾水/去離子水之洗滌瓶 | 1 | ||
| 250 cm3 燒杯 | 1 | ||
| 刮勺 | 1 | ||
* 
 |  |
| (圖195) 「S」 管 | (圖196) 製備和測試氣體 |
(iv) 實驗步驟
置小許紫色高錳酸鉀測試劑於 「S」 管 ‘U’ 形部份 (圖196)。用刮勺放小量固態亞硫酸鈉入試管,移約20滴1M硫酸。把 「S」 管內裝高錳酸鉀測試劑套上試管,試管底平均加熱至氣體釋放。小心觀察並以氧化還原化學方程幫助解釋。
(v) 觀察
紫色KMnO4(aq) 溶液變為接近無色。
2MnO4-(aq) + 5SO2(g) + 2H2O(l) → 2Mn2+(aq) + 5SO42-(aq) + 4H+(aq)
紫色 淺粉紅色
實驗 (9) : 離子遷移和用「電解棒」電解稀氯化鈉溶液加入通用指示劑
(i) 實驗目的
測試電解稀NaCl 溶液釋出酸性和鹼性離子。
(ii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
| 0.1M NaCl(aq) | 1 cm3 | 「電解棒」 | 1 |
| 通用指示劑 | 1 cm3 | 濾紙 | 1 |
| 剪刀 | 1 | ||
| 9 V 電池 | 1 | ||
| 塑料滴管 | 1 | ||
| 一小片墊底塑膠 | 1 | ||
| 放大鏡 | 1 | ||
(iii) 實驗步驟
置二滴 0.1M 氯化鈉溶液於一小塊濾紙上,跟著加入 一滴通用指示劑。把「電解棒」9V 電池組合輕輕按 上並透過一面放大鏡觀察 (圖197) 。 |
(圖 197) |
(iv) 實驗結果
陽極 (+) 和陰極 (-) 區域分別變為_____色和_____色
(v) 總結
__________________________________________________________________________________________________
__________________________________________________________________________________________________
(vi) 討論
觀察間接顯示呈酸性H+(aq) 和呈鹼性OH–(aq) 離子存在,同時釋放看不見之氫氣和氧氣。試以氧化/還原方程式解釋現象。
還原半方程式 : 2H+(aq) + e– → H2(g) (H+(aq) 離子遷移至負極)
氧化半方程式 : 4OH–(aq) – 4e– → O2(g) + 2H2O(l) (OH–(aq) 離子遷移至正極)
整體氧化還原反應 : 2H+(aq) + 2OH–(aq) → 2H2(g) + O2(g)
(陰極) (陽極)
H+(aq) 離子, 不是 Na+(aq) 離子, 選擇性地接收電子。H+(aq) 離子遷移至負極令通用指示劑變紅,同時間釋放H2,但氣體看不見。稀 NaCl溶液Cl–(aq) 離子濃度低,不會釋放電子。代替釋放電子的是OH–(aq) 離子。因此OH–(aq) 離子遷移至正極令通用指示劑變深藍,同時間釋放O2,但氣體看不見。
實驗 (10): 離子遷移和用「電解棒」電解稀碘化鉀溶液
(i) 實驗目的
電解檢查稀KI 溶液存在負離子。
(ii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
| 0.5M KI(aq) | 1 cm3 | 「電解棒」 | 1 |
| 濾紙 | 1 | ||
| 剪刀 | 1 | ||
| 9 V 電池 | 1 | ||
| 塑料滴管 | 1 | ||
| 一小片墊底塑膠 | 1 | ||
| 放大鏡 | 1 | ||
(iii) 實驗步驟
置二滴 0.5M 碘化鉀溶液於一小塊濾紙上,把「電解棒」9V電池組合輕輕按上並透過一面放大鏡觀察 (圖198) 。 |
(圖198) |
(iv) 實驗結果
陽極 (+) 和陰極 (-) 區域分別變為_____色和_____色。觀察到有像金屬般 ______ 沉積。
(v) 總結
______________________________________________________________________________________________________________________________________________________________________________________________________________________
(vi) 討論
細心觀察實驗 (10) 陽極區域會發現有光亮灰點附在棕色圓點上 (圖 198) 。試解釋光亮灰點之生成,並以方程顯示。
還原半方程式 : 2H+(aq) + e– → H2(g) (H+(aq) 離子遷移至負極)
氧化半方程式 : 2I–(aq) – 2e– → I2(s) (I–(aq) 離子遷移至正極)
I2(s) + I–(aq) → I3(aq)–
整體氧化還原反應 : 2H+(aq) + 3I–(aq) → I3–(aq) + H2(g)
(深棕色)
H+(aq) 離子, 不是 K+(aq) 離子, 選擇性地接收電子。 H+(aq) 離子遷移至負極釋放H2,因沒有通用指示劑,不見有顏色出現,也看不見氣體。I–(aq) 離子遷移至正極,釋放電子,生成I2(s) 。I2(s) 有光澤,看似金屬。I2(s) 溶於 KI溶液,生成深棕色絡合離子I3–(aq) 。
實驗 (11) : 微型過氧化氫與碘離子在酸性溶液中的反應總級數(碘時鐘反應)
(i) 背景資料
以下反應的速率可藉加入分量固定而少的S2O32-(aq)和澱粉指示劑來研習,
2O2(aq) + 2I-(aq) + 2H+(aq) → I2(aq) + 2H2O(l)
| H2O2(aq) + 2I-(aq) + 2H+(aq) → I2(aq) + 2H2O(l) | ……主反應 |
| S2O32-(aq) + I2(aq) → S4O62-(aq) + 2I-(aq) | …… 監控反應 |
| starch + I2(aq) → deep blue complex | …… 指示劑的反應 |
從上面的反應方程式可知,只要溶液混合物中有S2O32-(aq),從主反應生成的I2(aq) 會即時被用去,而不能使澱粉指示劑變色。不過,一旦所加入的少量S2O32-(aq) 耗盡,新生成的I2(aq) 便會立即使澱粉指示劑變為深藍色。
從上面的反應方程式可知,只要溶液混合物中有S2O32-(aq),從主反應生成的I2(aq) 會即時被用去,而不能使澱粉指示劑變色。不過,一旦所加入的少量S2O32-(aq) 耗盡,新生成的I2(aq) 便會立即使澱粉指示劑變為深藍色。
凡可以運用上述原理來研習的化學反應,稱為「時鐘反應」。若用碘來作指示的,稱為「碘時鐘反應」;同理,若用溴離子和甲基橙指示劑進行的,稱為「溴時鐘反應」。
時鐘反應動力學
溶液出現藍色所需的時間(t)反映了從主反應生成一定量碘所需的時間,因此1/t與I2(aq) 的生成速率成正比,而與 I–(aq) 或 H2O2(aq) 的濃度減少速率也成正比。若所加入的 S2O32-(aq) 愈少,則 (1/t) 值就會愈接近主反應的起始速率,因此實驗中必須使用少量的S2O32-(aq)。
在測定 I–(aq) 的反應級數時,可保持 H2O2(aq) 和 H+(aq) 的濃度不變,而按1:2:4:8 比例來改變 I–(aq) 的濃度。比較各次實驗所得的 (1/t) 值,若每次該值均加倍,則 I–(aq) 的反應級數是 1;若該值保持不變,則 I–(aq) 的反應級數是0。
用同樣的實驗方法,可分別測定出 H2O2(aq) 和H+(aq) 的反應級數。
(ii) 實驗目的
測定H2O2(aq) 與 I–(aq) 在酸性溶液的反應中,各反應物的反應級數。
a. I-(aq),
b. H2O2(aq) 和
c. H+(aq).
(iii) 安全措施
必須配戴安全措施眼鏡和不要讓皮膚沾上化學物品。跟隨老師指示棄置過量材料和化學廢料。 有關實驗使用之化學物品資料可參考Material Safety Data Sheet (MSDS)。 |
|
(iv) 試劑和儀器
| 試劑 | 數量 | 儀器 | 數量 |
| 0.60M H2SO4 | 5 cm3 | 八孔井穴條 | 2 |
| 0.60M KI | 5 cm3 | 微型膠滴管 | 1 |
| 1.50% H2O2 | 5 cm3 | 計時器 | 1 |
| 0.08M Na2S2O3 | 5 cm3 | *玻璃微型攪拌器 | 1 |
| 澱粉指示劑 | 5 cm3 | 250 cm3 燒杯內有去離子水作清洗用 | 1 |
| 去離子水 | 10 cm3 |
* 多數牙籤經過漂白,沾有還原/氧化劑,不宜採用。竹籤多數沒有漂白。
(v) 實驗步驟
(A) 碘離子反應級數
| 1. | 用乾淨的微量膠滴管,在一個八孔井穴條(A)的前四個井穴中,分別加入以下溶液各一滴:1.5%H2O2(aq)、0.6M H2SO4(aq)和澱粉溶液,因此每個井穴都有三滴溶液。 |
| 2. | 取另一八孔井穴條(B),在前四個井穴中,用乾淨的微量膠滴管各加入一滴0.08M Na2S2O3(aq)。 |
| 3. | 在八孔井穴條 (B) 的第一個井穴中再加入1滴0.6M KI(aq),在第二個井穴加入2滴0.6M KI(aq),在第三個井穴加入4滴0.6M KI(aq),而在第四個井穴加入8滴0.6M KI(aq) 。又把7滴去離子水加入第一個井穴中 ,6滴去離子水加入第二個井穴中,4滴去離子水加入第三個井穴中,使每個井穴內均混合有9滴溶液。 |
| 4. | 用微型攪拌器或竹籤把每個井穴內的溶液混合物攪勻。 |
| 5. | 小心覆置B於A之上,並須使兩者的前四個井穴都互相對準。 |
| 6. | 用橡皮圈把A和B的兩端縛緊固定,單手握住兩端,然後猛力把井穴條向下一搖,以使B的溶液落入A內,確保溶液徹底混合(單手「下搖」技巧),同時啟動計時器 (圖199)。也可以不用橡皮圈,雙手握住兩端,進行(雙手「下搖」技巧),(圖 200) 。 |
| 7. | 不斷地把A和B上下搖動,並注意觀察溶液何時轉為深藍色,記錄各個井穴內溶液轉為深藍色所需的時間。 |
| 8. | 用去離子水徹底清洗井穴條,並須把井穴內的水份去除。 |
 |  |
| (圖199) 橡皮圈把A和B的兩端縛緊單手「下搖」技巧 | (圖200) 不用橡皮圈之雙「下搖」技巧 |
表(一)
| 溶液份量 (滴) | ||||||
| 井穴條 A | 井穴條 B | |||||
| 井穴 | H2O2(aq) | H2SO4(aq) | 澱粉指示劑 | I-(aq) | H2O(l) | 0.08M S2O32-(aq) |
| 1 | 1 | 1 | 1 | 1 | 7 | 1 |
| 2 | 2 | 6 | ||||
| 3 | 4 | 4 | ||||
| 4 | 8 | 0 | ||||
(B) H2O2反應級數
根據表(二),重複實驗步驟1。
表(二)
| 溶液份量 (滴) | ||||||
| 井穴條 A | 井穴條 B | |||||
| 井穴 | I-(aq) | 0.08M S2O32-(aq) | 澱粉指示劑 | H2O2(aq) | H2O(l) | H2SO4(aq) |
| 1 | 1 | 1 | 1 | 1 | 7 | 1 |
| 2 | 2 | 6 | ||||
| 3 | 4 | 4 | ||||
| 4 | 8 | 0 | ||||
(C) H+ 反應級數
根據表 (三) 重複實驗步驟 (1) 至 (8) 。
表(三)
| 溶液份量 (滴) | ||||||
| 井穴條 A | 井穴條 B | |||||
| 井穴 | I-(aq) | 0.08M S2O32-(aq) | 澱粉指示劑 | H2SO4(aq) | H2O(l) | H2O2(aq) |
| 1 | 1 | 1 | 1 | 1 | 7 | 1 |
| 2 | 2 | 6 | ||||
| 3 | 4 | 4 | ||||
| 4 | 8 | 0 | ||||
(vi) 實驗結果
| 變項 | 相對濃度 | t (s) | 相對起始速率1/t (s-1) | 推測反應級數 |
| [I-(aq)] | 1 | 104 | 0.96 x 10-2 | 1 |
| 2 | 55 | 1.8 x 10-2 | ||
| 4 | 28 | 3.6 x 10-2 | ||
| 8 | 14 | 7.1 x 10-2 | ||
| [H2O2(aq)] | 1 | 115 | 0.87 x 10-2 | 1 |
| 2 | 58 | 1.7 x 10-2 | ||
| 4 | 29 | 3.4 x 10-2 | ||
| 8 | 14 | 7.1 x 10-2 | ||
| [H+(aq)] | 1 | 102 | 0.98 x 10-2 | – – – |
| 2 | 72 | 1.4 x 10-2 | ||
| 4 | 51 | 2.0 x 10-2 | ||
| 8 | 26 | 3.8 x 10-2 |
注意:
(1) 若起始速率因某反應物的濃度加倍而加倍,則這反應物的反應級數是1。
(2) 因微型儀器誤差率頗大,實驗要重複數次,取平均結果數據
(vii) 結論
______________________________________________________________________________________________________________________________________________________________________________________________________________________
___________________________________________________________________________________________________________
(viii) 思考題
1. 深藍色突然出現之時問是否反應完成之時間?
不是。深藍色突然出現之時問只是代表某份量反應產物,I2(aq),之產生時間。深藍色出現後反應繼續。
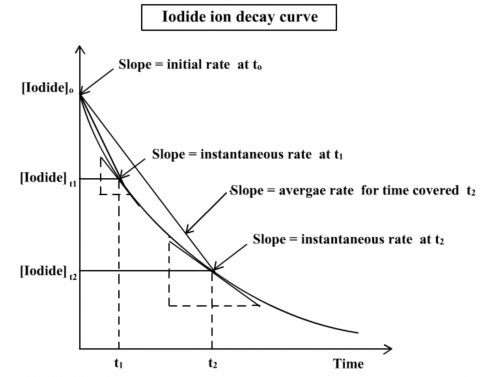
2. 利用圖線輔助,說明「起始速率」的意義。
根據主反應:
H2O2(aq) + 2I–(aq) + 2H+(aq) → I2(aq) + 2H2O(l)
下圖為碘離子濃度的衰變曲線。三名詞需要闡述:(i) 平均速率 = 消耗之[I–]/需要時間t,(ii) 於時間 t之瞬時速率 = 衰變曲線於時間 t之斜率和 (iii) 起始速率 = 衰變曲線於零時間之斜率。三者不一樣,以起始速率最快 (圖 198) 。
(Fig. 201) 碘離子濃度的衰變曲線
3. 為甚麼說:要獲得起始速率,t的值便必須小?
從上述圖線,要獲得較準確的起始速率,必須在反應開始後短時間內可以測量碘離子濃度的變化。若時間延長,引起之副反應機率越大,所得的平均速率便不能視為起始時的純反應速率,方程式中的「起始速率」是反應起始時的瞬時速率。
4. 為甚麼要選用反應的起始速率而非其它時段的速率(即瞬時速率)來進行測定?
測量反應速率有兩種方法: (i) 從圖表推算 (graphical)和 (ii) 從實驗數據算 (non-graphical) 。平均速率和起始速率都可以從實驗數據算,但瞬時速率必須從衰變圖之斜率推算,即作圖後才可以測定。若反應速率不採用圖表推算法,則只可用實驗數據提供作平均速率計算。從圖198可見若t趨向 0,平均速率可視作起始速率。
5. 為甚麼加於反應混合物中的S2O32-(aq)分量必須少?
加入的S2O32-(aq) 作用如同一道閘 ,限制多少H2O2(aq)或 I–(aq) 作起始反應。S2O32-(aq) 作用是把生成的碘消耗 ,阻止澱粉變色,S2O32-(aq) 耗完後溶液混合反應物即時變藍 ,顯示實驗終點 (但主反應還繼續,直至完成)。S2O32-(aq) 越少,用作測量速率之H2O2(aq)或 I–(aq) 越少,這樣才能縮短藍色出現所需的時間來達到測量起始速率的目的 。為了獲得較準確H2O2(aq)或 I–(aq)濃度減少的起始速率,加入的S2O32-(aq)必須要少。但t不可以小於5秒,否則計時有困難。
6. 根據各反應物的反應級數,寫出反應的速率方程式。
 = k[I-(aq)][H2O2(aq)]
= k[I-(aq)][H2O2(aq)]
速率常数k是某一溫度 (多以 298 K)下之常數。以「碘時鐘反應」為例,[I–(aq)] 和 [H2O2(aq)] 皆為1 mol dm-3情況下測量之反應速率。
7. 根據主反應: H2O2(aq) + 2I–(aq) + 2H+(aq) ¾¾® I2(aq) + 2H2O(l),反應的速率方程式為什麼不是 = k[I–(aq)]2[H2O2(aq)][H+(aq)]2?
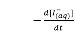 = k[I-(aq)]2[H2O2(aq)][H+(aq)]2?
= k[I-(aq)]2[H2O2(aq)][H+(aq)]2?
反應方程式主要功能是計量參與反應之反應物。按主反應方程式各計量係數 (stoichiometric coefficient),在過量酸化下,一摩爾 H2O2和兩摩爾KI反應生成一摩爾 I2(aq)。提供之資料和速率沒有直接關係。反應的速率方程式基於基元反應 (elementary reaction),不是總反應 (overall reaction)。下題闡述如何達至速率方程式。
8. 主反應的反應機理包含以下三個基元步驟:
| H2O2(aq) + I-(aq) → X + H2O(l) | …… (慢) |
| H+(aq) + X → Y | …….(快) |
| Y + H+(aq) + I‑(aq) → I2(aq) + H2O(l) | …….(快) |
為使上述速率決定步驟的速率表示式與實驗所得的速率方程式相吻合,X和Y應是甚麼?
X = OI-(aq), Y = HOI(aq)
慢基元反應控制整個反應速率,是速率決定之步驟,其他兩個快基元反應可以不考慮。結果:反應的速率方程式
 = k[I-(aq)][H2O2(aq)]
= k[I-(aq)][H2O2(aq)]
上式和從實驗數據計算之速率方程式相同。
(ix) 備註
1. 使用微型儀器的優點
使用微型器材來進行實驗除了具備一般優點外,還有以下三項優點是傳統方法所沒有的
(a) 以試劑溶液的滴數來衡量其相對濃度,可省卻使用真實濃度(mol dm-3),大大簡化了計算過程。
(b) 能夠同時進行四組試驗,而無須逐一進行,這可把某反應物的級數測定縮短在1分鐘內完成。
(c) 能令實驗步驟儘量簡化,有助學生理解和掌握實驗的目的。
2. 「1 2 4 8」技巧
這是研習反應動力學是一種非圖像化方法。顧名思義,就是把某反應物的濃度按1:2:4:8比例遞增,而其它反應物濃度不變。若反應速率亦同樣以1:2:4:8遞增,即表示此反應物的級數是1;但若反應速率是按照(1)2: (2)2: (4)2: (8)2的比例遞增,則表示此反應物的級數是2;若反應速率並沒有因讓反應物濃度增加而增加,則表示此反應物的級數是零。有關DSE化學科課題,反應物不是一級反應就零級反應。
3. 「碘時鐘反應」不是一個獨立化學反應。它其實只是一種方法研習於適量硫代硫酸離子和澱粉指示劑情況下,酸化過氧化氫氧化碘離子之反應速率。這氧化/還原反應伴隨顏色改變 (由無色變棕色) ,亦可以用比色計進行動力學調研。本課程實驗 (25) 描述測定這反應之反應級數。
「碘時鐘反應」
實驗 (12) : 微型定量測定酸化硫代硫酸鈉之反應速率 – “消失交叉” 實驗
(i) 實驗目的
1. 研究S2O32-(aq) 和H+(aq) 反應的反應速率和濃度之間的關係。
2. 建立S2O32-(aq) 和H+(aq) 反應的反應速率方程式。
(ii) 簡介
硫代硫酸鈉和稀硫酸的反應方程式:
S2O32-(aq) + 2H+(aq) → S(s) + SO2(g) + H2O(l)
上述反應的反應速率方程式:
Rate = k([S2O32-(aq)] n) ([H+(aq)]m)
反應進行時,保持 [S2O32-(aq)] 的量不變,能夠找出 [H+(aq)] 的反應級數m。同樣地保持 [H+(aq)] 的量不變,可以找出 [S2O32-(aq)] 的反應級數n。這方法稱「偽級數」(pseudo-order) 反應。
本次實驗追蹤測量的可變量是硫化產物,而考慮的條件就是形成一定硫沉澱所需要的時間。採用這種方法能令我們更為方便地記錄因為沉澱物的形成而令一個符號 (畫在紙上) 變得看不到時所需要的時間。
在這個實驗,為了令反應快速進行,會利用8孔井穴板,「連續變化」和「下搖」技朽。
(iii) 安全指引
戴上安全眼鏡,避免皮膚與化學藥品直接接觸。請根據實驗室輔導員的指示傾倒及棄置廢物和多餘藥品。 |
|
(iv) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
* 0.25M Na2S2O3 (aq) | 5 cm3 | 8孔井穴倏 | 2 |
* 1M H2SO4(aq) | 5 cm3 | 微型膠移液管 | 4 |
去離子水 | 5 cm3 | 50cm3燒杯 | 4 |
燈箱(Light table) [如果有] | 1 | ||
秒錶 | 1 | ||
微波攪拌器或竹籤 | 5 | ||
棉花棒 | 5 | ||
白紙、筆 | 1@ | ||
*
(v) 實驗步驟
(A) 不同濃度S2O32-(aq) 的影響
1. 根據下列數據,用乾淨的微型膠移液管將0.25M Na2S2O3 (aq) 和去離子水移到已清潔過的8孔井穴條 (A) 中。
| A條號碼 | A1 | A2 | A3 | A4 | A5 | A6 | A7 | A8 |
| Na2S2O3 (aq) 容積/ (滴) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 去離子水容積/ (滴) | 7 | 6 | 5 | 4 | 3 | 2 | 1 | 0 |
2. 如下表所示,用乾淨的微型膠移液管將1M H2SO4(aq) 和去離子水移到另一8孔井穴條中 (B)。
| B條號碼 | B1 | B2 | B3 | B4 | B5 | B6 | B7 | B8 |
| 1M H2SO4(aq)容積/ (滴) | 7 | 7 | 7 | 7 | 7 | 7 | 7 | 7 |
| 去離子水容積/ (滴) | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
3. 置8孔井穴條於白紙上,用筆畫出井穴條的輪廓,並且標上一個交叉 (X) 在7個孔的位置。(如果有燈箱[Light table],將紙放在燈箱上)。
4. 反轉井穴條 (A),放在井穴條(B)上,令井穴條 (A) 的孔能夠確實地置於井穴條 (B) 的孔上(兩個孔相連)
5. 將兩個井穴條緩緩向上拿穩並用力向下墜 (「下搖」技巧),令兩個孔的液體能夠均勻地混和,並同時開始啟動秒錶。
6. 將井穴條B分開,將井穴條 (B) 對應放在交叉上。
7. 記錄每一個交叉消失分別需要的時間 (圖 202)。
8. 為了防止膠體硫磺沉澱黏附井穴孔,實驗完成後必須立即用移液管移除生成物,並依老師指示適當處理。用濕棉花棒和清潔劑清潔井孔,最後用水沖洗井孔。
(圖 202) 觀測 “X” 的消失
(B) 不同濃度H+(aq) 的影響
9. 根據下列數據,用乾淨的微型膠移液管將1M H2SO4(aq)和去離子水移到已清潔過的8孔井穴條 (A) 中。
| A條號碼 | A1 | A2 | A3 | A4 | A5 | A6 | A7 | A8 |
| 1M H2SO4(aq)容積/ (滴) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 去離子水容積/ (滴) | 7 | 6 | 5 | 4 | 3 | 2 | 1 | 0 |
10. 如下表所示,用乾淨的微型膠移液管將0.25M Na2S2O3 (aq)和去離子移到另一個8孔井穴條 (B) 中。
| B條號碼 | B1 | B2 | B3 | B4 | B5 | B6 | B7 | B8 |
| Na2S2O3 (aq) 容積/ (滴) | 7 | 7 | 7 | 7 | 7 | 7 | 7 | 7 |
| 去離子水容積/ (滴) | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
11. 重複步驟 (4) 至 (8)。
(vi) 實驗結果
完成下列表格。
| 實驗A | 實驗B | ||||
| S2O32-(aq)濃度的比例 | t(s) | 1/t(s-1) | H2SO4(aq)濃度比例 | t(s) | 1/t(s-1) |
| 1 | 1 | ||||
| 2 | 2 | ||||
| 3 | 3 | ||||
| 4 | 4 | ||||
| 5 | 5 | ||||
| 6 | 6 | ||||
| 7 | 7 | ||||
| 8 | 8 | ||||
(vii) 數據處理
將以上表格的資料輸入至Excel並完成上述表格,並特別註明t和1/t各欄的數值和製作一個圖表。選擇「帶有資料的X-Y散佈圖」,繪製一個流線圖,並建立一個標題及將X,Y軸標籤。
(viii) 討論和總結
1. 什麼是「連續變化」(continuous variation) 技巧?
「連續變化」技巧是一種特別稀釋技巧。参考實驗 (A) 第一步驟,當試劑 8: 7: 6: 5: 4: 3: 2: 1比例滴入井穴跟着用清水以0: 1: 2: 3: 4: 5: 6: 7比例滴注入相關井穴。這樣,最終各井穴濃度便以 ![]() 比例減少。若各井穴液體容積不保持一樣,那麼各井穴液體濃度便要每加一滴清水計算一次。
比例減少。若各井穴液體容積不保持一樣,那麼各井穴液體濃度便要每加一滴清水計算一次。
2. 列出另一種可以測量反應速率的方法。
測量反應時pH值改變。(注意:不宜考慮收集SO2,因這氣體之溶解度相當大。)
3. 簡單地描述反應速率隨著S2O32-(aq)和H+(aq)濃度改變時的規律。
(i) 反應速率與濃度成正比例。
(ii) 反應速率與H+(aq)濃度無關。
4. 從圖表中,找出S2O32-(aq)和H+(aq)和反應級數。
對 S2O32-(aq)為一級反應;對 H+(aq)為零級反應
5. 寫出反應速率方程式。
反應速率 = k[S2O32-(aq)]
(ix) 網頁搜尋
從其他網頁中找出一個最慢和最快的化學反應。核反應為核自身的放射性衰變,不涉及電子重整,不視作化學反應。化學反應涉及電子重整,最終會化合或分解反應物的反應。
慢反應:鐘乳石和石筍之形成 /石之形成 / 鐵生銹
快反應:汽車猛烈相撞瞬間氣袋產生之化學反應 / 爆炸
(x) 總結
_____________________________________________________________________________________________________
_____________________________________________________________________________________________________
汽車防撞氣袋原理
汽車防撞氣袋原理
實驗 (13) : 過氧化碘時鐘反應活化能
(i) 實驗目的
測定酸化過氧化氫溶液和碘化物溶液反應之活化能。
(ii) 簡介
傳統「碘時鐘反應」是用酸化過氧化氫溶液氧化碘化物溶液並以硫代硫酸鹽作監測元素。
| 2I-(aq) + 2H+(aq) + H2O2(aq) → I2(aq) + 2H2O(l) | ……主反應 |
| I2 (aq) + 2S2O32-(aq) → 2I-(aq) + S4O62-(aq) | ……監測反應 |
| I2(aq) + starch → deep blue complex | ……指示劑反應 |
主反應生成之碘立刻和硫代硫酸鹽反應而被抵消,澱粉指示劑不受影響。過一段時間後,當少量的硫代硫酸鹽全部被消耗後,隨後產生之碘會影響澱粉指示劑,並突然呈現深藍色。記錄主反應生成一固定質量碘所需的時間。
這類實驗通常採用混合兩組溶液混合物之方法。一組由 I–(aq) 和澱粉指示劑組成
而另一組則為酸化 H2O2 溶液和硫代硫酸鹽溶液之混合物。反應要於四個不同溫度進行:即 30oC、 40℃、 50oC 和 60oC。記錄突然出現深藍色需要之時間。根據阿列紐斯方程式:k =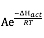 或 ln(k) = ln(A) –
或 ln(k) = ln(A) –![]() , 以 ln(
, 以 ln(![]() ) vs (
) vs (![]() ) 作圖應為一直線。從直線斜率可得活化能, ΔHact。
) 作圖應為一直線。從直線斜率可得活化能, ΔHact。
(iii) 安全措施
配戴安全護鏡,不要讓皮膚接觸任何化學藥物。儘量用最少份量反應物料。按老師指示處理過量物料和反應剩餘物。 |
|
(iv) 試劑和儀器
試劑 | 份量 | 儀器 | 份量 |
FA 1*: (10 cm3 0.6M H2SO4 + 2.5 cm3 6.5% H2O2) 稀釋至 90 cm3 | 90 cm3 | 小型加熱器 | 1 |
FA 2*: (10 cm3 0.6M KI + 10 cm3 0.08M S2O32- + 20 cm3 0.2% starch) 稀釋至 90 cm3 | 90 cm3 | 12V DC 電源 | 1 |
大試管 | 2 | ||
600 cm3 燒杯 | 2 | ||
25 cm3 量筒 | 2 | ||
0-110oC 温度計 | 2 | ||
秒錶 | 1 |
*
(v) Experimental procedures
| 1. | 轉移10 cm3 FA 1 至一標記為 A 之大試管 |
| 2. | 轉移10 cm3 FA 2 至另一標記為 B 之大試管。 |
| 3. | 置兩大試管 A 和 B 於一充當熱絕緣體之 250 cm3 燒杯。把一個小型熱器探測器放入大試管 A, 另一個小型加熱器探測器放入大試管 B,確保探測器探頭完全浸沒。分別把一支溫度計放入每支大試管 (圖 204)。 |
| 4. | 啓動小型加熱器操作檯之切換開關 (toggle switch)。觀察兩溶液溫度上升。用玻璃溫度計攪拌溶液 (圖 203)。 |
| 5. | 當溫度達到約 57oC 時,關掉切換開關。.重複地按紅色 Push-on ON/OFF 開關,直至穩定和精確之 60oC 溫度維持一分鐘。 |
| 6. | 把FA 1 溶液倒入 FA 2 溶液。當一半的溶液完成轉移後開始計時。 |
| 7. | 以 0.01 秒精確度,記錄深藍色突然出現的時間。 |
| 8. | 反應完成後即時再次量度溶液温度。 |
| 9. | 分別於 50oC、40oC 和 30oC 温度重覆三次實驗。 |
 |  |
| (圖 203) 小型加熱器操作檯和匹配之加熱探測器A和B | (圖 204) 大試管/燒杯/加熱探/测器隔熱裝置 |
特別注意:一如所有家用電水壺,加熱器若不在水(或水溶液)中便不可以通電。
(圖 205) 加熱器線路圖
(vi) 數據顯示
實驗之反應速率可以下式表示:
「速率」 = 1/反應時間
分別以每次實驗結果完成下表。
實驗 | 起始溫度/ K | 終止溫度/ K | 平均溫度/ K | 反應時間 t / s | ‘速率’ = 1/t s-1 |
1 | 333.0 | 331.0 | 332.0 | 16 | 0.0625 |
2 | 323.0 | 322.0 | 322.5 | 29 | 0.0345 |
3 | 313.0 | 312.3 | 312.7 | 51 | 0.0196 |
4 | 303.0 | 302.7 | 302.9 | 94 | 0.0106 |
(vii) 數據處理和計算
| 實驗 | 平均溫度/ K | 1/T | ( | (ln |
| 1 | 332.0 | 0.003012 | 0.0625 | -2.7726 |
| 2 | 322.5 | 0.003101 | 0.0345 | -3.3673 |
| 3 | 312.7 | 0.003199 | 0.0196 | -3.9332 |
| 4 | 302.9 | 0.003302 | 0.0106 | -4.5433 |
以 (ln ) vs 1/T 作圖並從直線斜率計算活化能, ![]() (即Ea)。
(即Ea)。
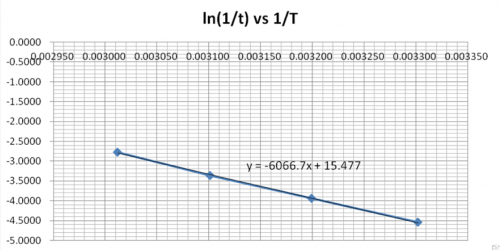

(viii) 討論
(a) 解釋 是否正值或負值。
ΔHact 為正值,表示反應要吸取熱能去克服 ΔHact才可以進行反應。
(b) 以計算之ΔHact數據來考慮,反應是快還是慢?突然出現之深藍色只是和反應時間有關係嗎?實驗實質測量了什麼時間?
ΔHact = 50.4 kJ mol-1 之反應不算快速。突然出現之深藍色和主反應有間接關係。出現深藍色反應和主反應不是同一反應,但同時間進行。深藍色出現顯示硫代硫酸鹽耗盡由反應起始碘離子生成之碘。深藍色出現之時間實質是主反應生成一定質量碘 (由硫代硫酸鹽控制)之時間。
(c) 簡釋 是否依靠温度。
溫度不影響反應之 ΔHact 數據
(d) 何種因素影響活化能?
催化劑。利用適當催化劑可降低反應之活化能。
(e) 反應速率和速率常數有什麼分別?
按: 反應速率 = 速率常數 [反應物] n 。若反物濃度為 1 mol dm-3,n = 1,測定之反應速率就是速率常數。
(f) 一個實用定量估算方法 (經驗法則,rule of thumb) 是反應每增加10oC,速率便會增加一倍。這方法可在實驗反映出来嗎?試解釋。
(i) 實驗結果驗證了 (經驗法則):
| 平均溫度/ K | ( |
| 332.0 | 0.0625 |
| 322.5 | 0.0345 |
| 312.7 | 0.0196 |
| 302.9 | 0.0106 |

(g) 概述三個決定實驗反應速率之條件。(不包括反應物形態)
濃度,溫度 和催化劑。
(h) 陳述二個步驟誤差和二個儀器誤差。提議減少這些誤差來源方法。
| 來源 | 減少方法 | |
| 步驟誤差 | 1. A溶液和B溶液並不同步混合 2. 突然變藍反應時間慢 | 1. 重複實驗 2. 由反應時間快同學主持實驗 |
| 儀器誤差 | 1. 溫度計不準確 2. A溶液和B溶液溫度不一樣 | 1. 選擇校正率相同之溫度計 2. 選擇電阻一樣之探頭A和探頭B |
(ix) 結論
(x) 網頁搜索
每提升溫度10oC,反應速度增加約一倍。但若化應加入無機催化劑 (catalyst) 降低反應活化能,則可以大幅度提升反應速度。酶 (enzyme,酵素) 可以視作人體生理機能之有機催化劑,酶如可控制人體生理機能效能?上網尋根究底。
酶,或稱酵素 (Enzyme),是一類大分子生物催化劑。酶能加快化學反應的速度(即具有催化作用)。由酶催化的反應中,反應物稱爲基質,生成的物質稱爲產物。幾乎所有細胞內的代謝過程都離不開酶。酶能大大加快這些過程中各化學反應進行的速率,使代謝產生的物質和能量能滿足生物體的需求。細胞中酶的類型對可在該細胞中發生的代謝途徑的類型起決定作用。
酶抑制劑(Enzyme inhibitor)是一類可以與酶結合併降低其活性的分子。 由於阻斷酶的活性可以殺死病原體或糾正代謝失衡,許多藥物都是酶抑制劑。 它們也用於殺蟲劑。酶抑制劑最常見的用途是作為治療疾病的藥物。例如細菌被稱為肽聚糖(Peptidoglycan) 的網狀聚合物製成的厚細胞壁包圍。 許多抗生素如青黴素 (penicillin) 和萬古黴素 (Vancomycin) 可以抑制產生這種聚合物鏈的酶,然後將這些聚合物交聯在一起。 這導致細胞壁失去強度並令細菌破裂。
氨甲蝶呤(Methotrexate,又稱甲氨喋呤、甲氨蝶呤、氨甲喋呤)氨甲蝶呤是一種化療藥物和免疫抑制劑,被用來治療癌症、藥物為葉酸拮抗劑 (Folic acid antagonist),與葉酸差競爭同一酵素。
很多酶抑制劑都是手性蛋白質 (chiral protein inhibitor)。其光學左/右旋對影體 (R/S enantiomer) 有相同分子質量,但兩者可以具相同、不同和極端不一樣藥性。手性藥物是近年發展非常重要之藥物系列。
實驗 (14) : 測定常溫常壓 (r.t.p.)下之氣體常數R
(i) 實驗目的
測定丁烷的摩爾體積以取得氣體常數。
(ii) 實驗前資料收集 (互聯網連接)
1. 尋找於一大氣壓,250C (r.t.p.)下氮氣和氯氣之密度。
互聯網資科:氮氣密度 = 1.15 g dm-3; 氯氣密度 =2.95 g dm-3
2. 以作圖方法找出兩種氣體質量和容積之關係。
氣體體積vs氣體質量
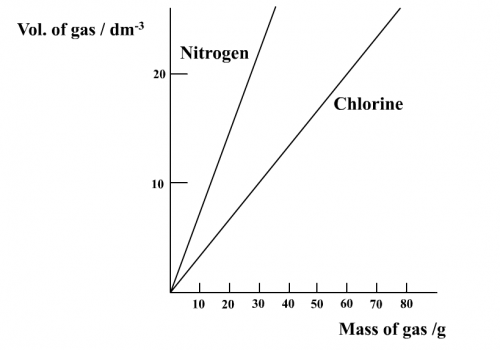
3. 從圖推導以上兩種氣體一摩爾之容積。
一摩爾氮 (28 g) 容積 = 24 dm3
一摩爾氯 (71 g) 容積 = 24 dm3
一摩爾氮容積 =一摩爾氯容積 = 24 dm3
若想進一步推導結果,假設所有一摩爾氣容積都是 24 dm3,你需要做些甚麼?
用其他氣體如二氧化碳或打火機之丁烷氣體重複實驗。
(iii) 儀器簡介
微型氣體RMM測定套件 (圖206) 是用來快捷測定丁烷 (butane,C4H10) 在室温和1氣壓的條件下,相應分子質量的創新儀器。用AA膠將一個填滿丁烷的打火機噴嘴連接皮下注射器的尖端,而皮下注射器的頂端則套上一小節膠管。膠管連接一個60 cm3的塑膠注射器。按着打火機的板柄將丁烷氣體從打火機釋放進入塑膠注射器 (圖207)。丁烷的體積可以通過測量實驗前後打火機的質量而得知。獲得相關數據後我們便可計算出丁烷氣體的摩爾體積或氣體常數,假設已知丁烷的RMM,室温和氣壓。
| (圖 206) 測定分子量之微型儀器套件 | (圖 207) 釋出丁烷 |
(iv) 物料和儀器
RMM套件包括:
1. 一個60 容量一次性塑膠注射器,
2. 一個充滿丁烷氣體的打火機連接皮下注射針嘴和一小節矽氧脂塑膠管,
3. 一支備用的皮下注射針,
4. 一小節矽氧脂塑膠管,
全部放置於吸塑膠盤中 (圖203)。
(v) 實驗步驟
1. 量稱打火機及注射器的重量,準確到至少01g (圖208)。
2. 釋出丁烷氣體到60毫升的塑膠注射器直至收集到60毫升的丁烷 (圖209)。
3. 放出丁烷氣體後,再量稱打火機的重量 (圖210)。
4. 假設丁烷的摩爾質量是58g mol-1,計算丁烷氣體在r.t.p.狀態下的摩爾體積,並與標準值相比。
5. 假設室温是250C,大氣壓為101325Pa,計算氣體常數R,並與標準值相比
| (圖208) | (圖209) | (圖210) |
釋放丁烷
釋放丁烷
(vi) 結果和計算
丁烷氣體打火機的初始質量 = 12.89 g
丁烷氣體打火機的最終質量 = 12.75 g
已釋出的丁烷氣體的質量 = 0.14 g
丁烷氣體的摩爾數 = 0.14/58 = 0.002414
收集到的丁烷氣體體積 = 60
1摩爾丁烷氣體的體積 = [60 x 1/0.002414 ] cm3 = 24855 cm3
(R.T.P狀態下摩爾體積的標準值 = 24000 )
實驗錯誤率 = [(24855 – 24000/24000) x 100] % = 3.6%
所有根據標準值的實驗錯誤率小於5%為可忽略的誤差。
根據理想氣體方程式: PV = nRT
現有:
P = 101325 N/m-2, V = 60 cm3= 6×10-5 m3, T = (25+273) K = 298 K and
n = 0.00241 mol
代入理想氣體方程式 PV = nRT:
(101325N/m-2)(6 x 10-5 m3) = (0.00241mol) R (298K)
R = 8.465 Nm K-1 mol-1 (4 sig. figures)
= 8.465 J K-1 mol-1
(標準值;R = 8.314 J mol-1), 誤差 +1.8%
s.t.p. 摩爾體積計算:V1/T1 = V2/T2;V1 = 24855 cm3,T1 = 298 K,V2 =?cm3
T2 = 273K, V1 = 24855 cm3, T1 = 298 K,V2 =?cm3,T2 = 273K
(24855 cm3)/(298 K) = (?cm3) / (273 K)
? = 22770 cm3 = 22.77 dm3
s.t.p. 摩爾體積計算為22.77 dm3
(v) 討論
1. 為甚麼氣體方程式叫「理想」? 「真實」的情況是怎樣?
理想氣體方程式假設:(i)沒有分子間引力和 (ii)分子沒有體積。「真實」情況是:(i)分子間有引力和 (ii)分子有體積。
2. 簡釋甚麼情况下真實氣體可當作「理想」氣體。
在極高溫度和極低氣壓下會出現「理想」情況。因為在這個情況下氣體分子互相距離很遠。
3. 如何量計「真實」氣體?
「理想」情況偏差可以 PV = nRT作修正,令數據接近真實。修正方程式稱作范德華方程式:[P + a(n/V)2] (V – nb) = nRT,a和 b分别為分子間引力和分子體積之修正常數。
(vi) 網頁搜索
連接網絡,然後搜尋合適的網頁,找出室温 (r.t.p.)下的摩爾體積與標準狀況 (s.t.p.) 下的摩爾體積的分別為多少。
r.t.p. 下的摩爾體積 | s.t.p. 下的摩爾體積 |
24.47 dm3 |
(vii) 總結
______________________________________________________________________________________________________________________________________________________________________________________________________________________6
實驗 (15) : 定性和定量小型電解儀器 –「電解管」
(i) 實驗目的
1. 收集電解氫氧化鈉溶液釋放之氣體。
2 測試收集之氣體。
3. 測量產生之鹼性氫氧燃料電池電動勢。
(ii) 簡介
直流電電解電解質溶液為一分解反應。過程為一氧化還原反應。稀氫氧化鈉溶液在陰極 (負極) 釋放氫氣 ,而在陽極 (正極) 則釋放氧氣。前者容積和後者容積的比例為 2:1。
陰極: 4H+(aq) + 4e → 2H2(g)
陽極: 4OH-(aq) – 4e → O2(g) +2H2O(l)
總氧化還原反應: 2H+(aq) + 2OH-(aq) → 2H2(g) + O2(g)
釋放之氧氣會重燃暗紅木條 (或香枝),而氫氣和空氣混合後遇火種便會爆炸,產生 “爆鳴” 現象。
(iii) 安全措施
配戴安全護鏡,不要讓皮膚接觸任何化學藥物。儘量用最少份量反應物料。按老師指示處理過量物料和反應剩餘物。 |
|
(iv) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
| * 0.5 M NaOH(aq) | 100 cm3 | 「電解管」 | 1 |
| 9V 電池 | 2 | ||
| DMM | 1 | ||
| 膠滴管 | 1 | ||
| 少許 “Blu Tack” 泥膠 | 2 份 | ||
| 丁烷打火機 | 1 | ||
| 一次性膠手套 | 1 對 | ||
| 9V 電池蓋連接線 | 1 | ||
| 木條或香枝 | 1 | ||
| 100 cm3 燒杯 | 1 | ||
| 鱷魚夾連電線 | 2 | ||
*
(v) 實驗步驟
(a) 氫氣與氧氣之容積比例
1. 注適量5 M NaOH溶液入100 cm3 燒杯。置「電解管」 (圖 211) 於燒杯上 (圖 212) ,校正溶液水位於「電解管」之 2 cm3 刻度處。
2. 用少 “Blu Tack” 泥膠封閉「電解管」之兩小孔 (圖 212)。輕輕提起「電解管」,看看水位是否還位於2 cm3 刻度處 (圖 213)。這步驟肯定小孔沒有漏氣。
3. 將兩枚 9V 電池電線鱷魚夾連接「電解管」引導柱,開始電解 (圖 214)。
4. 進行實驗至約5 cm3氣體收集於陽極管。量度收集於陰極管氣體之容積。若燒杯之NaOH溶液因滿溢而排走轉移,可用一皮氏培養皿蓋回收 (圖 216)。
| (圖 211) | (圖 212) | (圖 213) | (圖 214) |
準備和開始電解
O2:H2 容積比
| (圖 215) | (圖 216) |
(b) 測量生成之鹼性氫氧燃料電池電動勢
5. 移除電池,即時用 DMM 測量「電解管」兩引導柱之間之電壓。測量之電壓可視作鹼性氫氧燃料電池之電動勢 (圖 213) 。測量之電壓會快速下降 ,因為形成之燃料電池內阻甚高,電動勢很快耗盡。
生成之鹼性氫氧燃料電池
(c) 測試氫氣
6. 配戴一次性膠套 。提升「電解管」離開電解溶液 ,用手指封閉陰極管,倒轉管組合。丁烷打火機點火,組合移近火種,即時放開手指。觀察現象 (圖 217),留意聲響。
「爆鳴」測試
(d) 測試氫氧混合氣體
7. 重複實驗步驟 (1) 至 (4) 。當實驗進行一半時,把「電解管」(+) (-) 電極反轉 ,令陰極變陽極,陽極變陰極。
8. 繼續實驗至「電解管」兩管內混合氣體容積皆為 3 cm3。
9. 丁烷打火機點火,提升「電解管」離開電解溶液,倒轉管組合令管內混合氣體溢出並即時移近火種,觀察現象並留意更大的聲響 (圖 217)。
(e) 測試氧氣
(圖 217) | (圖 218) |
10. 由頭再開始實驗,不過這次移走封閉「電解管」陰極管之 “Blu-Tack”。結果是解管陽極管內不停儲存釋放之氣體 ,直至管內填滿氣體 。準備一枝暗紅香枝。 移走電池,快速提升「電解管」並即時放入暗紅香枝 (圖 218)。小心觀察。
測試氧氣
(vi) 實驗結果
(A) 直流電電解稀電解質溶液如 NaOH,NaCl,H2SO4 等會釋出 _____ 氣 (正極) 和______ 氣 (負極)。結果是把水分裂為 _________和 ________。
(B) 完整電解水氧化還原方程式:
__________________________________________________________________
(C) 網上資料列出鹼性氫氧燃料電池電動勢為 + 1.23 V 。實驗 (15) 之簡單鹼性氫氧燃料電池電動勢 = ______________ V
(D) 這實驗驗是經典的 _____ 氣「爆鳴」測試。
(E) 氧氣和氫氣之混合氣體其破壞力遠比單一氫氣大。
(F) 氧氣可重燃半熄滅火種,是燃燒需要之 _____ 大因素之一。
(vii) 備註
1. 稀NaOH溶液為這實驗之電解質溶液,因為其他電解質溶液如稀NaCl、H2SO4等溶液會氧化和腐蝕金屬正電極。
2. 發熱線 (Nichrome wire) 作為電極是因為它有很強抗拒空氣氧化特性。即使加熱至發紅,冷卻回室溫後沒有絲毫變化,還原原來外表。
3. 氣體釋放產生氣泡,令以溶液表面位置作標準之半月彎液面難以觀察。可取的方法是移走電池,停止電解一會兒。半月彎液面隨後會變得明顯。
4. 測量電池電動勢不可以用普通指針式電壓錶,要用高輸入阻抗電壓錶。一般萬用數字電錶,DMM (digital multi-meter),輸入電阻有10 MΩ (107 Ω)。量度取用少許訊號源電流,DMM 顯示之電壓可視作電動勢。
5. 設計提供一簡易和可攜帶性工具進行定性和定量電解。沒有地點限制,是介紹電解課題一個很好的開始實驗
(viii) 討論
為甚麼實驗 (B) 測量氫氧燃料電池電動勢時量度電壓之數據急速下降?
鹼性氧標準還原電極電位:O2(g) +2H2O(l) + 4e–→ 4OH–(aq) ΦE /V = +1.23 V
氫標準還原電極電位:2H+(aq) + 2e– → H2(g) ΦE /V = 0.00 V
由兩半電池組成之鹼性氫氧燃料電池圖:
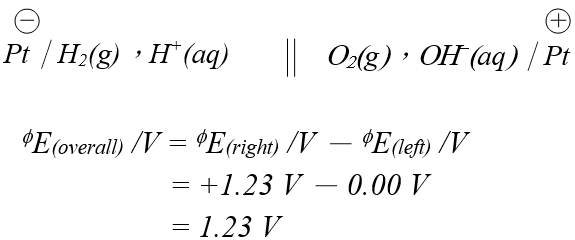
理論上鹼性氫氧燃料電池之電動勢為1.23 V。
實驗 (B) 得到的起始數據只有 1.02 V,遠低於期望之 1.23 V。原因很多,主要是(i) 電極不是使用惰性金屬鉑,(ii) 設施並不是由兩個獨立半電池組成,(iii) 電解後除了產生氫和氧,也產生其他雜質等。
實驗 (B) 產生之原始鹼性氫氧燃料電池內阻極高。按公式 V = iR 考慮,原始鹼性氫氧燃料電池只可以提供微弱電流。一旦由外界儀器 (DMM) 測量其電動勢,測量儀器會取走電訊源電流,負荷電訊源 (課程 (1) 主題 8.2 簡易公式計算第 65-66頁 instrument loads the source signal), 令量度電壓數據急速下降。
(ix) 互聯網搜尋
上世紀80年代有化學家聲稱在室溫電解重水 (D2O) 可觀察到核聚變,公佈震驚科學界,因為核聚變 (nuclear fusion) 公認的理解認為只可以在極高溫度和氣壓下才可以進行一如太陽的核聚變才可以產生巨大能量,把氘 (deuterium,2H) 和氚 (tritium,3H) 聚變成氦 (helium,4He) 和中子(neutron,1n) 。
D + T → He + n.
一段時間有很大迴響和反對聲音,尤其是實驗不具覆核性。試從網站尋找這次爭議之來龍去脈,並評論冷核聚變之可能性和應用之局限性。
冷核聚變 (Cold fusion)是指理論上在接近常溫(1000K以下),常壓和相對簡單的設備條件下發生核聚變反應。核聚變反應中,多個輕原子核被強行聚合形成一個重原子核,並伴隨能量釋放。
1989年弗萊希曼(Martin Fleischmann)和龐斯(Pons,Stanley)公佈了在室溫條件下,他們用簡單的重水 (D2O) 電解裝置,在鈀電極上實現了持續的核聚變。他們所使用的電解裝置極為普通,電解液由99.5%的重水和0.5%的普通水加入少量的氘氫化鋰 (LiD) 製成。電解液裝在長20.32cm的試管中,溫度為27℃。重水中插入兩根電極,陰極為鈀 (palladium) 極,陽極為鉑 (platinum)極。通電流後,氘離子在鈀極聚集、融合,並釋放出核聚變的典型物質:氚、中子和γ射線,並有熱量釋放。所釋放的熱量比實驗耗用的能量多出4倍,他們一致認為,這是種 “冷聚變” 。不過多人經多次實驗都不能複製這項實驗 ,被認為是一場騙局 。但近年再有人重拾這議題,並以小規模應用為目標,積極嘗試為冷核聚變尋找一條出路,尤其發展為小型移動能源。3
實驗 (16) : 測定propan-1-ol的燃燒摩爾焓變
(i) 實驗目的
測定propan-1-ol的標準燃燒摩爾焓變,ΔHΦcomb 。
(ii) 方法簡介
燃燒烷醇釋放熱和生成二氧化碳和水。Propan-1-ol 完全燃燒:
2C3H7OH (l) + 9O2(g) –> 6CO2(g) + 8H2O (g) ΔHΦcomb = -2020 kJ mol-1
測定propan-1-ol的燃燒摩爾焓變只需一台簡單的熱量計。 方法是燃燒小量已知質量之酒精並令其火熖加熱一小塊鋁塊。 記錄金屬塊的溫度增加 (即DT) 和以ΔH = (ms) ΔT程式計算propan-1-ol的燃燒摩爾焓變。
傳統熱量計用水和酒精進行實驗,方法是以燃燒定量烷醇令水溫上升。燃燒熱計算基於公式ΔH = (ms) ΔT。這「單實驗校正」處理,即只用一次實驗,代入文獻數據 s 常數進行計算,是有很多缺點的。主要誤差是由環境熱流失引起的,即實驗數據 ΔT並不可靠,需要修正。理論上可以牛頓冷卻定律 (上網搜尋) 作圖求得修正之 ΔT’ ,代入公式即可。或改善環境絕熱程度,令燃燒熱不流失。兩者都花時間,得到之結果也未必理想。
本實驗採用「雙實驗校正」處理,較「單實驗校正」優勝。顧名思義,「雙實驗校正」要用兩次實驗處理。燃燒兩種烷醇而不是壹種烷醇。方法令不用修正 ΔT和消除環境熱量流失。步驟要點如下:棄用加熱水和容器,改為加熱一小塊鋁柱體;代入其中一烷醇之燃燒熱文獻數據和量度溫度變化。

若代入實驗數據m1、 m2、 ΔT1 和 ΔT2而M1, 和M2為常數,則已知 ΔH1便可計算ΔH2,反之亦然。
「單實驗校正」處理考慮鋁比熱 (s) 文獻數據。「雙實驗校正」處理則代入烷醇燃燒熱文獻數據 ΔHcomb (本實驗為乙醇之燃燒熱) 。
(iii) 安全措施
佩帶安全眼鏡並避免化學製品與皮膚接觸. 根據老師的指示去處理化學製品廢料和剩餘材料。 |
|
(iv) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
* Ethanol,propan-1-ol | 1 cm3 @ | 有腳園柱形小鋁塊熱量計 | 1 |
| 小圓柱形玻璃盛載器皿 | 1 | |
數位體溫計 | 1 | ||
塑膠移液管 | 1 | ||
電子天平 (分析度 ± 0.00克) | 1 | ||
丁烷打火機 | 1 |
*
(v) 實驗步驟
(A) 燃燒乙醇
1. | 用塑膠移液管移5滴乙醇至小型玻璃圓柱形盛器。稱量乙醇質量。 |
2. | 記錄鋁塊的開始溫度。 |
3. | 用丁烷打火機燃著乙醇,置於鋁塊下。 保持乙醇繼續燃燒直至全部乙醇燒完為止。記錄鋁塊的最高溫度。 |
4. | 用水冷卻鋁塊至室溫。 |
(B) 燃燒丙醇 (propan-1-ol)
5. | 用丙醇重覆步驟 (1) 至 (4) |
(圖219) 鋁塊熱量計器和小型圓柱形玻璃盛器 | (圖220) 鋁塊熱量計器、數字溫度計和小型圓柱形玻璃盛器的相對大小 | (圖221) 實驗裝置 |
(v) 實驗結果
實驗 (A): 乙醇質量 (m1) = 0.0875 g
熱量計開始溫度 = 28.9 oC
熱量計最高溫度 = 40.0 oC
ΔT1 = (40.0 – 28.9) = 11.1 oC
實驗 (B): 丙醇質量 (m2) = 0.0925 g
熱量計開始溫度 = 28.8 oC
熱量計最高溫度 = 43.7 oC
ΔT2 = (43.7 – 28.8) = 14.9 oC
(vi) 計算
文獻數據:
乙醇燃燒標準焓變 ΔHΦcomb , ΔH1 = -1300 kJ mol-1
乙醇相對分子質量 = 46 g mol-1,丙醇Propan-1-ol相對分子質量 = 60 g mol-1

(vii) 總結
________________________________________________________________________________________________________________________________________________________________________________________________________________________
(viii) 備註
* 儀器微型化沒有使用地點的局限。
* 熱流失是實驗誤差一個主要原因。 因此應在沒有氣流的地方做實驗。
* 不完全燃燒構成實驗誤差。小心觀察沒黃色火焰。
(ix) 討論
1. 試陳述一理論考慮消除環境熱流失。
若考慮「單實驗校正」處理,加熱鋁塊和記錄上升最高溫度,移走烷醇火焰並繼續實驗。加熱曲線會一升一慢降,因熱流失去四周環境 (下圖) 。應用牛頓冷卻定律:環境熱流失與過量溫度成正比例,計算某溫度之流失熱,從而推算應有之上升值。整個原來加熱曲線作此修正便得出一理想加熱曲線,呈較大斜率上升至最高溫度後變平坦,顯示沒有熱流失。因此從實驗得出之最高溫度 ΔT要修正為 ΔT’(高於ΔT) 。
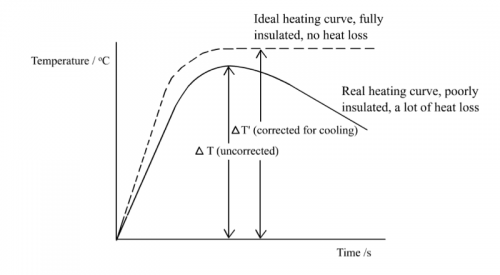
由此可見,計算燃燒標準焓變公式 ΔH = (ms) ΔT應修正為 ΔH = (ms) ΔT’。
2. 因「雙實驗校正」處理不考慮熱容量 (ms) ,所以由量稱鋁塊引起之誤差不存在。方法需要兩烷醇其中之一的燃燒標準焓變文獻數值。+ 6.6% 實驗誤差仍存在。試列一方法減少誤差。
調校燃燒乙醇和甲醇質量,盡量令兩者之實驗上升溫度升幅達致一樣。這情況下可視作兩實驗處於相同環境,若有熱流失也互相抵銷。
(x) 網頁搜尋
大家有沒有留意長征3系列火箭起飛時噴出火焰外還有大量棕色氣體。這些棕色氣體究竟是什麼?火箭之液態燃料又是什麼?燃燒時為什麼會產生棕色氣體?有毒的嗎?有更好的燃料嗎?上網找個答案。
二氧氮烷,肼 (hydrazine)是一種良好的火箭燃料。雖然燃燒熱 ΔHΦcomb只有 – 621 kJ mol-1,但與適當的氧化劑配合,如四氧化氮 (N2O4) 可組成比沖很高的可貯存液體推進劑,廣為用作送衛星上太空之火箭液態推進劑。總燃燒方程:
2N2H4 (l) + N2O4(l) → 3N2(g) + 4H2O(g)
過程產生NO(g) 中介物,而NO極快被氧化為棕色NO2(g)。N2O4(l) 又 和NO2(g) 達成化學平多衡: N2O4(l) ![]() 2NO2(g) 因此長征3系列火箭點火時有大量棕色NO2氣體溢出。NO2(g) 為有毒氣體,是引起酸雨的一個來源,並不環保。改良的長征5系列火箭液體推進劑採用液態氧和煤油 (kerosene),推力更大,燃料無毒,符合環保要求。
2NO2(g) 因此長征3系列火箭點火時有大量棕色NO2氣體溢出。NO2(g) 為有毒氣體,是引起酸雨的一個來源,並不環保。改良的長征5系列火箭液體推進劑採用液態氧和煤油 (kerosene),推力更大,燃料無毒,符合環保要求。
美國NASA夥同民間企業於十年前已着手研究液態甲烷/液態氧火箭發動機。目的是人類殖民火星。前往火星燃料可在地球製造,但從火星返回地球之燃料必須在火星製造。火星大氣層約有95% CO2。CO2和 H2 (從燃燒產物電解水) 以Sabatier process 反應生成 CH4。上網搜尋有關 Raptor rocket engine、SpaceX 和 Starship資料。
實驗 (17): 組合銻電極酸度計 「壹點校正」
(i) 簡介
量測量水溶液 pH 基本上是量度由放進水溶液之電極所產生之電動勢。現今一般都採用對 H+(aq) 靈敏之玻璃和銀/氯化銀參考電極來量度H+(aq) 濃度。不過,現在製造玻璃電極仍然昂貴,對要購買多台玻璃電極pH 計作學生實驗之中學來說也是一項財政負擔,不用說玻璃電極也有短壽命缺點。事實上,早於上世紀初已發現銻金屬作為半電池電極於水溶液中會產生電動勢,其數值與溶液中之 H+(aq) 濃度相關。這發現提供了定量測量 pH 另一種方法。近期,因為可以微型化和準確地量度pH 6 至 8範圍 (血液為一pH 7.4 之緩衝溶液),銻電極再被發現用於醫學儀器方面 (回顧主題5.1「銻電極酸度計」。
(ii) 實驗目的
1. 製備金屬銻和銅/硫酸銅組合電極
2. 採用主題1 設計之pH 傳感器,利用pH 7 「壹點校正」步驟校正銻電極pH計
(iii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
* 1M CuSO4 溶液 | 1 cm3 | 金屬銻和銅/硫酸銅參考電極 | 1對 |
pH 2 , 4, 7, 10, 13 緩衝溶液 | 10 cm 3 | pH傳感器 | 1 |
通用指示劑 | 1 cm 3 | 塑膠移液管 | 5 |
微型塑膠移液管 | 1 | ||
24井穴板 | 1 | ||
250 cm3 燒杯內有去離子水 | 1 | ||
DMM和接線 | 1 | ||
「鹽栓」 | 3 | ||
砂紙 | 1小塊 |
*
(iv) 實驗步驟
製備金屬銻和銅/硫酸銅組合電極
1. 製備銅/硫酸銅參考電極:如 (圖222) 顯示,用微型塑膠移液管滴 1 M CuSO4溶液入玻璃管小空格至全滿,表面現半月灣形 (圖223)。用一「鹽栓」牢牢封閉管口 (圖224)。要注意小空格不可以有氣泡,否則會影響溶液電導,令輸出訊號電壓不穩定。(圖225) 顯示完成金屬銻和銅/硫酸銅組合電極。
(圖 222) | (圖 223) | (圖 224) | (圖 225) |
2. 用砂紙清潔金屬銻電極一端。
3. 用塑膠移液管移約20滴pH 2, 4, 7, 10, 13緩衝溶液於24井穴板其中5井穴,每一井穴加3滴通用指示劑。
4. 接連金屬銻和銅/硫酸銅組合電極電纜線至傳感器輸入香蕉形插座,傳感器輸出DC插座連接至DMM,選擇2000 mV 滿度顯示。啟動傳感器。
5. 置金屬銻和銅/硫酸銅組合電極於pH 7井穴。稍後一刻令氧化還原達至平衡。
6. 調校傳感器旋鈕至DMM顯示 70 mV,固定旋鈕,不再轉動。銻電極pH計已作pH 7 「壹點校正」 了,可以量度其他溶液之pH值。
7. 若金屬銻和銅/硫酸銅組合電極置於pH 2緩衝溶液,DMM會顯示約20 mV,若用pH 4緩衝溶液,DMM會顯示約40 mV,如此類推。這就是「DMM顯示技巧」。DMM以數字顯示實驗結果,但不帶單位。
8. DMM 在 (圖 226) 顯示之70 mV視作 pH = 7.0。
 (圖 226) “壹點”pH 7.0 校正
(圖 226) “壹點”pH 7.0 校正
實驗 (18) : 強酸vs強鹼滴定曲線 (0.1M HCl vs 0.1M NaOH)
(i) 實驗目的
以校正之金屬銻組合電極pH計和「DMM顯示技巧」,製作強酸vs強鹼滴定曲線圖
(ii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
* 1M CuSO4 溶液 | 1 cm3 | 金屬銻和銅/硫酸銅參考電極 | 1對 |
0.1 M HCl 溶液 | 10 cm 3 | pH傳感器 | 1 |
0.1 M NaOH 溶液 | 10 cm 3 | 巴斯德移液管 (Pasteur pipette) | 5 |
pH 7 緩衝溶液 | 10 cm 3 | 塑膠移液管 | 1 |
通用指示劑 | 1 cm 3 | 微型塑膠移液管 | 1 |
酚酞指示劑 | 1 cm 3 | 24井穴板 | 1 |
250 cm3 燒杯內有去離子水 | 1 | ||
DMM | 1 | ||
「鹽栓」 | 3 | ||
砂紙 | 1小塊 | ||
電腦安裝軟件試算表「Excel」 | — | ||
*
(iii) 實驗步驟
(A) 製備金屬銻和銅/硫酸銅組合電極和 「壹點校正」 銻電極pH計
重複實驗 (17) 步驟1 – 6 製備金屬銻和銅/硫酸銅組合電極。以pH 7緩衝溶 「壹點校正」 銻電極pH計。
(B) 滴定曲線圖
| 1. | 利用巴斯德移液管加25滴0.1 M HCl於24井穴板其中一井穴,跟隨再用塑膠移液管加1大滴酚酞指示劑。 |
| 2. | 連接銻組合電極電纜線至傳感器輸入,傳感器輸出接DMM。DMM 選擇2000 mV 滿度檔。啟動傳感器。 |
| 3. | 置銻組合電極於24井穴板內裝25滴0.1 M HCl之反應穴。 |
| 4. | 搖晃銻組合電極一會,停30秒,記錄 DMM顯示之穩定pH值。 |
| 5. | 徹底清冼原先巴斯德移液管。再用同一巴斯德移液管裝入0.1 M NaOH,逐滴加入反應井穴。DMM顯示數字不停變化。記錄每加一滴後之穩定DMM顯示。觀察反應井穴之顏色變化。 |
| 6. | 繼續定滴實驗,直至加入40滴0.1 M NaOH。 |
(iv) 實驗結果
0.1 M NaOH 滴數 | pH | 0.1 M NaOH 滴數 | pH |
0 | 2.3 | 21 | 4.8 |
1 | 2.7 |
|
|
2 | 2.9 | 23 | 5.2 |
3 | 3.1 | 24 | 5.7 |
|
| 25 | 9.5 |
5 | 3.4 | 26 | 11.0 |
|
| 27 | 11 .0 |
7 | 3.6 | 28 | 11.1 |
9 | 3.8 | 30 | 11.5 |
11 | 4.0 | 32 | 11.6 |
13 | 4.1 | 34 | 11.8 |
15 | 4.3 | 36 | 11.8 |
17 | 4.5 | 38 | 12.0 |
19 | 4.7 | 40 | 12.0 |
(v) 數據處理
1. 啟動微軟「Excel」軟件。建立數據欄和pH欄,分別輸入滴數和pH值。
2. 從主菜單單擊「插入」,再選擇「圖表」圖標。
3. 選擇「XY 散點圖」。
4. 整理各軸和各座標,建造一適宜pH 滴定圖表 (下圖)。
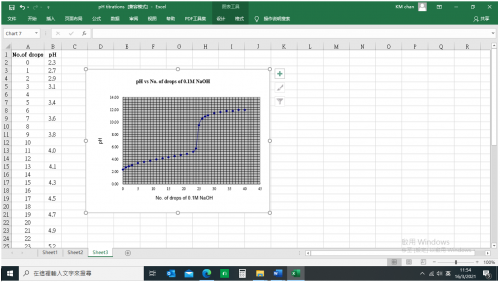
(vi) 0.1 M HCl vs 0.1 M NaOH 滴定曲線
(vii) 思考題
為什麼滴定要用巴斯德移液管而不用塑膠移液管?
 |  |
巴斯德移液管 | 塑膠移液管 |
巴斯德移液管管身由玻璃製造,有瘦長直徑平均尾咀,每次滴出液體容積誤差不大。塑膠移液管管身短,手指壓力影響塑膠管身直徑,每次滴出液體容積有較大誤差。
實驗 (19) : 弱酸vs強鹼滴定曲線 (0.1M CH3COOH vs 0.1M NaOH)
(i) 實驗目的
以校正之金屬銻組合電極pH計和「DMM顯示技巧」,製作弱酸vs強鹼滴定曲線圖
(ii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
* 1M CuSO4 溶液 | 1 cm3 | 金屬銻和銅/硫酸銅參考電極 | 1對 |
0.1 M CH3COOH 溶液 | 10 cm 3 | pH傳感器 | 1 |
0.1 M NaOH 溶液 | 10 cm 3 | 巴斯德移液管 (Pasteur pipette) | 5 |
pH 7 緩衝溶液 | 10 cm 3 | 塑膠移液管 | 1 |
通用指示劑 | 1 cm 3 | 微型塑膠移液管 | 1 |
甲基橙指示劑 | 1 cm 3 | 24井穴板 | 1 |
250 cm3 燒杯內有去離子水 | 1 | ||
DMM | 1 | ||
「鹽栓」 | 3 | ||
砂紙 | 1小塊 | ||
電腦安裝軟件試算表「Excel」 | — | ||
*
(iii) 實驗步驟
(A) 製備金屬銻和銅/硫酸銅組合電極和 「壹點校正」 銻電極pH計
重複實驗 (17) 步驟1 – 6 製備金屬銻和銅/硫酸銅組合電極。以pH 7緩衝溶液 「壹點校正」 銻電極pH計。
(B) 製作滴定曲線圖
| 1. | 利用巴斯德移液管加25滴0.1 M CH3COOH於24井穴板其中一井穴,跟隨再用塑膠移液管加1大滴甲基橙指示劑。 |
| 2. | 連接銻組合電極電纜線至傳感器輸入,傳感器輸出接DMM。DMM 選擇2000 mV 滿度檔。啟動傳感器。 |
| 3. | 置銻組合電極於24井穴板內裝25滴0.1 M CH3COOH之反應穴。 |
| 4. | 搖晃銻組合電極一會,停30秒,記錄 DMM顯示之穩定pH值。 |
| 5. | 徹底清冼原先巴斯德移液管。再用同一巴斯德移液管裝入0.1 M NaOH,逐滴加入反應井穴。DMM顯示數字不停變化。記錄每加一滴後之穩定DMM顯示。觀察反應井穴之顏色變化。 |
| 6. | 繼續定滴實驗,直至加入40滴0.1 M NaOH。 |
(iv) 實驗結果
0.1 M NaOH 滴數 | pH | 0.1 M NaOH 滴數 | pH |
0 | 2.3 | 21 | 4.8 |
1 | 2.7 |
|
|
2 | 2.9 | 23 | 5.2 |
3 | 3.1 | 24 | 5.7 |
|
| 25 | 9.5 |
5 | 3.4 | 26 | 11.0 |
|
| 27 | 11 .0 |
7 | 3.6 | 28 | 11.1 |
9 | 3.8 | 30 | 11.5 |
11 | 4.0 | 32 | 11.6 |
13 | 4.1 | 34 | 11.8 |
15 | 4.3 | 36 | 11.8 |
17 | 4.5 | 38 | 12.0 |
19 | 4.7 | 40 | 12.0 |
(v) 數據處理
1. 啟動微軟「Excel」軟件。建立數據欄和pH欄,分別輸入滴數和pH值。
2. 從主菜單單擊「插入」,再選擇「圖表」圖標。
3. 選擇「XY 散點圖」。
4. 整理各軸和各座標,建造一適宜pH 滴定圖表 (下圖)。

(vi) 0.1 M CH3COOH vs 0.1 M NaOH 滴定曲線

(vi) 思考題
為什麼滴定要用巴斯德移液管而不用塑膠移液管?
 |  |
巴斯德移液管 | 塑膠移液管 |
巴斯德移液管管身由玻璃製造,有瘦長直徑平均尾咀,每次滴出液體容積誤差不大。塑膠移液管管身短,手指壓力影響塑膠管身直徑,每次滴出液體容積有較大誤差。
實驗 (20) : 組合銻電極酸度計基本校正 (不用傳感器)
(i) 實驗目的
1. 進行銻組合電極pH 計基本校正
2. 製作 (i) 強酸vs強鹼 和 (ii) 弱酸vs強鹼滴定曲線圖
(ii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
* 1M CuSO4 溶液 | 1 cm3 | 金屬銻和銅/硫酸銅參考電極 | 1對 |
* 1M HCl 溶液 | 1 cm3 | 巴斯德移液管 (Pasteur pipette) | 5 |
0.1 M CH3COOH 溶液 | 10 cm 3 | 塑膠移液管 | 1 |
0.1 M NaOH 溶液 | 10 cm 3 | 微型塑膠移液管 | 1 |
pH 2, 4, 7 10 和13 緩衝溶液 | 10 cm 3 | 24井穴板 | 1 |
通用指示劑 | 1 cm 3 | 250 cm3 燒杯內有去離子水 | 1 |
酚酞指示劑/甲基橙指示劑 | 1 cm 3@ | DMM | 1 |
「鹽栓」 | 3 | ||
砂紙 | 1小塊 | ||
*
(iii) 實驗步驟
(A) 銻組合電極 pH 直線圖表基本校正
1. 如 (圖227),所示,用微型塑膠移液管滴 1 M CuSO4溶液入玻璃管小空格至全滿,表面現半月灣形 (圖228)。用一「鹽栓」牢牢封閉管口 (圖229) 。 注意小空格不可以有氣泡,否則會影響溶液電導,令輸出訊號電壓不穩定。用砂紙清潔金屬銻電極一端。(圖 230) 顯示完成金屬銻和銅/硫酸銅組合電極,準備實驗。
(圖 227) | (圖 228) | (圖 229) | (圖 230) |
2. 分別置pH 2, 4, 7 10 和13 (即0.1M NaOH(aq)) 緩衝溶液於24井穴板5個井穴內。各井穴加 3滴通用指示劑溶液。
3. 銻組合電極電纜線香蕉插連接 DMM 正負輸入插座 (DMM旋鈕轉至 2000 mV 檔)。銻組合電極首先放入pH 2緩衝溶液井穴內,稍作晃動令穴內溶液濃度平均分佈和達至氧化還原平衡。記錄電壓數據 (圖 231)。
4. 清洗銻組合電極,再放入pH 4緩衝溶液井穴內,稍作晃動令穴內溶液濃度平均分佈和達至氧化還原平衡。記錄電壓數據 (圖 232)。
5. 清洗銻組合電極,再分別放入pH 7, 10 和 13 緩衝溶液井穴內,稍作晃動令穴內溶液濃度平均分佈和達至氧化還原平衡。記錄電壓數據 (圖 233, 234, 235)。
(圖 231) | (圖 232) | (圖 233) |
(圖 234) | (圖 235) |
6. 開啟微軟「Excel」試算表軟件。 7. 設一2列6欄表格,列之數值各為pH值和銻組合電極電動勢。 8. 輸入pH和電動勢數據e.m.f. 。 9. 選擇圖表精靈跟着X-Y散佈圖。 10. 右擊顯示之e.m.f. vs pH 直線圖,從趨勢線格式取得圖表上顯示公式: e.m.f. = 斜率 (pH) + 截距。 11. 按校對方程式e.m.f. = (0.0529) pH + 0.0968,輸入指令轉換方程式 = PRODUCT(18.90,SUM(e.m.f.,-0.0968)) 12. 在Raw e.m.f. 數據欄小格輸入任何e.m.f. 值,即時在pH欄小格出現相關 pH值。例如在B10小格輸入raw e.m.f. = 0.66 V便立刻從 A10 小格得 pH = 10.7。 |
(iv) 實驗結果
pH | 2 | 4 | 7 | 10 | 13 |
銻銅組合電極電動勢 / V | 0.21 | 0.31 | 0.46 | 0.61 | 0.80 |
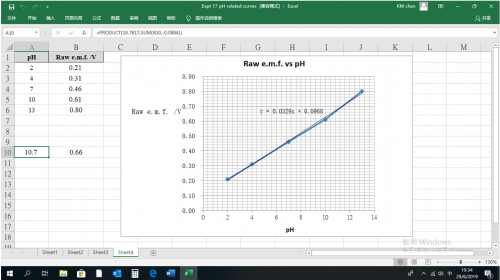
| 相關直線方程式: | y = 0.0529x + 0.0968 |
| 校正方程式: | e.m.f. = (0.0529) pH + 0.0968 |
不用傳感器取得 pH 值方法:
| (i) | 從校正方程式計算:若測量電電動勢 = 66 mV,代入公式得 66 = (0.0529) pH + 0.0968,pH 值為10.65。 |
| (ii) | 於「Excel」頁,raw e.m.f. 欄一空小格輸入 66 V,傍邊 pH小格便即時顯示 10.7。 |
(B) 製作 (i) 強酸vs強鹼 和 (ii) 弱酸vs強鹼滴定曲線圖
(i) 製作0.1 M HCl vs 0.1 M NaOH滴定曲線圖
實驗步驟
| 1. | 利用巴斯德移液管加25滴1 M HCl於24井穴板其中一井穴,跟隨再用塑膠移液管加1大滴酚酞指示劑。 |
| 2. | 連接銻組合電極電纜線香蕉插至DMM輸入插座。DMM 選擇2000 mV 滿度檔。 |
| 3. | 置銻組合電極於24井穴板內裝25滴1 M HCl之反應穴。 |
| 4. | 搖晃銻組合電極一會,停30秒,記錄 DMM顯示之電壓值 (Raw e.m.f.)。 |
| 5. | 徹底清冼原先巴斯德移液管。再用同一巴斯德移液管裝入1 M NaOH,逐滴加入反應井穴。DMM顯示數字不停變化。記錄每加一滴後之穩定DMM顯示。觀察反應井穴之顏色變化。 |
| 6. | 繼續定滴實驗,直至加入40滴1 M NaOH。 |
| 7. | 利用實驗 (A) 之 Excel試算表,輸入Raw e.m.f.,記錄顯示之 pH值。 |
實驗結果
0.1 M NaOH 滴數 | pH | 0.1 M NaOH 滴數 | pH |
0 | 1.5 | 21 | 2.2 |
1 | 1.5 |
| |
2 | 1.5 | 23 | 2.3 |
3 | 1.5 | 24 | 2.7 |
| 25 | 3.3 | |
5 | 1.5 | 26 | 9.3 |
| 27 | 10.6 | |
7 | 1.6 | 28 | 10.9 |
9 | 1.6 | 30 | 11.3 |
11 | 1.6 | 32 | 11.3 |
13 | 1.8 | 34 | 11.5 |
15 | 1.8 | 36 | 11.5 |
17 | 1.8 | 38 | 11.6 |
19 | 2.0 | 40 | 11.6 |
數據處理
1, 啟動微軟「Excel」軟件。建立數據欄和pH欄,分別輸入滴數和pH值。
2. 從主菜單單擊「插入」,再選擇「圖表」圖標。
3. 選擇「XY 散點圖」。
4. 整理各軸和各座標,建造一適宜pH 滴定圖表 (下圖)。
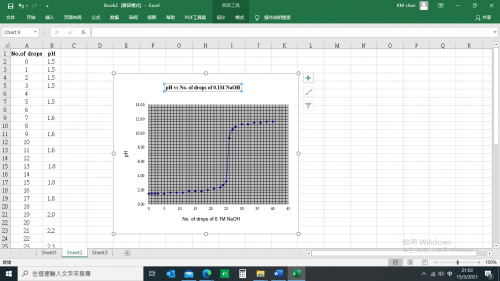
0.1 M HCl vs 0.1 M NaOH滴定曲線圖
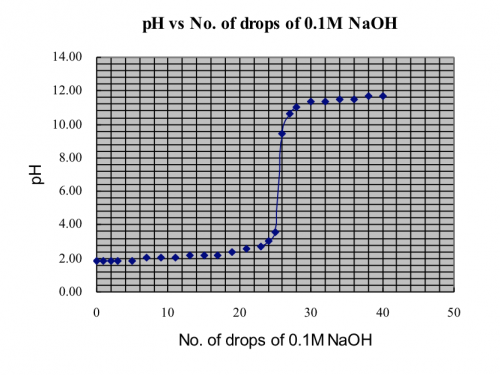
(ii) 製作0.1 M CH3COOH vs 0.1 M NaOH滴定曲線圖
實驗步驟
1. 重複實驗 (i) 實驗步驟1至7,以1 M CH3COOH取代0.1 M HCl。下表顯示結果。
| 0.1 M NaOH 滴數 | pH | 0.1 M NaOH 滴數 | pH |
0 | 2.3 | 21 | 4.9 |
1 | 2.7 |
| |
2 | 2.9 | 23 | 5.2 |
3 | 3.1 | 24 | 5.7 |
| 25 | 9.5 | |
5 | 3.4 | 26 | 10.6 |
| 27 | 10.9 | |
7 | 3.6 | 28 | 11.1 |
9 | 3.8 | 30 | 11.5 |
11 | 4.0 | 32 | 11.6 |
13 | 4.1 | 34 | 11.8 |
15 | 4.3 | 36 | 11.8 |
17 | 4.5 | 38 | 12.0 |
19 | 4.7 | 40 | 12.0 |
2. 啟動微軟「Excel」軟件。建立數據欄和pH欄,分別輸入滴數和pH值。
3. 從主菜單單擊「插入」,再選擇「圖表」圖標。
4. 選擇「XY 散點圖」。
5. 整理各軸和各座標,建造一適宜pH 滴定圖表 (下圖)

0.1 M CH3COOH vs 0.1 M NaOH滴定曲線圖

備註
雖然不用傳感器方法而只用軟件去計算 pH 值可達致小數兩位數,但銻電極電動勢準確性不足以有此位數。這方法計算 pH 值只可以小數壹位數顯示。
實驗 (21) : 微型電解質溶液電導率探究
(i) 實驗目的
1. 鑑定電解質溶液和非電解質溶液
2. 鑑定強或弱電解質溶液
3. (i) 強電電解質和 (ii) 弱電電解質之電導率與稀釋關係
(ii) 簡介
遊離離子令溶液電導。離子鍵化合物溶於水,生成遊離離子因而電導。強極性共價鍵化合物 ( covalent compounds with ionic character),如乙酸,也會電導,不過弱一點。純共價鍵化合物如糖溶液或弱極性共價鍵化合物如乙醇則不電導。
(iii) 安全措施
配戴安全護鏡,不要讓皮膚接觸任何化學藥物。氨水和冰醋酸有強烈氣味和刺激性,要配適當口罩。對這此些氣體敏感學生要先咨詢醫生。儘量用最少份量反應物料。按老師指示處理實驗步驟,化學藥物,過量物料和反應剩餘物。 |
|
(iv) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
** 冰(100%)乙酸 | 50 cm 3 | 微型電導探頭 | 1 |
* 1 M H2SO4 | 100 cm 3 | 電導傳感器 | 1 |
* 1 M CH3COOH | 100 cm 3 | 巴斯德移液管 (Pasteur pipette) | 5 |
1 M NaCl | 100 cm 3 | 醫學用口罩 | 1 |
* 1M NH3(aq) | 100cm 3 | 有機Combo井穴板 | 1 |
Sat. NaCl (aq) | 100 cm 3 | 100 cm3 燒杯 | 5 |
20% 葡萄糖溶液 | 10 cm 3 | DMM | 1 |
95% C2H5OH | 10 cm 3 | 微型攪拌棒 | 1 |
去離子水 | 適量 | 砂紙 | 1小塊 |
* |
| ** |
|
(v) 實驗步驟和結果
(A) 鑑定電解質溶液和非電解質溶液
1. 標籤有機Combo 井穴板之小穴 1 – 8 (Combo 井穴板共有 6 x 2 大穴和 12 x 4 小穴) 。每次 用一清潔巴斯德滴管,以下表方法於 8 個小井穴放入各種溶液:1.
(表1)
小井穴排名 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
溶液 | 10 drops of deionized water | 10 drops of 20% glucose solution | 10 drops of 95% ethanol | 10 drops of 1M ethanoic acid | 10 drops of 1M sulphuric acid | 10 drops of 1M sodium hydroxide | 10 drops of 1M ammonia | 10 drops of 1M sodium chloride |
2. 連接 DMM (2000 mV 選擇檔),電導傳感器,微型電導探頭。開啟傳感器,稍候1分鐘熱身。用一小節金屬條 「短路校正」 儀器。首先轉動傳感器旋鈕調校輸出為 100 mV,作100 滿度校正 (圖 236)。跟着再轉動傳感器旋鈕調校輸出為 300 mV為滿度,作300 滿度校正 (圖 237)。這步驟強化數據顯示。增加3倍令小數據有較大變化之顯示。傳感器旋鈕調校幅度要顧及這方面要求。
(圖 236) 100 mV「短路校正」 | (圖 237) 300 mV 「短路校正」 |
3. 採用100 滿度校正:置探頭於井穴1,少許搖晃。探頭尖處於井穴底。停止搖動,等候顯示穩定。記錄 DMM 數據。
4. 用去離子水清洗探頭。置探頭於井穴2,少許搖晃。探頭尖處於井穴底。停止搖動,等候顯示穩定。記錄 DMM 數據。
5. 重複步驟 (4) ,直至井穴 3, 4, 5, 6, 7,和 8都完成實驗。
6. 改用300 滿度校正,重複步驟 (3) 至 (5) ,完成下表:
(表2)
小井穴排名 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
溶液 | 10 drops of deionized water | 10 drops of 20% glucose solution | 10 drops of 95% ethanol | 10 drops of 1M ethanoic acid | 10 drops of 1M sulphuric acid | 10 drops of 1M sodium hydroxide | 10 drops of 1M ammonia | 10 drops of 1M sodium chloride | |
DMM顯示 / mV | 300FS | 2 | 2 | 2 | 15 | 243 | 222 | 14 | 184 |
100FS | 1 | 1 | 1 | 5 | 81 | 74 | 5 | 61 | |
(B) 鑑定強或弱電解質溶液
按 (表2) 所示之相對電導率,完成下 (表3),分成三大類。(表3)
非電解質 | 弱電解質 | 強電解質 | |
溶液 |
(C) (i) 強電電解質和 (ii) 弱電電解質之電導率與稀釋關係
據 (表2) 結果及使用已有之反應物,探究稀釋作用與以下,溶液電導率之影響: (i) sat. NaCl,(ii) 1 M NaCl, (iii) 100% CH3COOH和 (iv) 1 M CH3COOH。
首先如 (圖235) 矩陣式標籤有機Combo全部井穴板以利分析。板面分為列和欄,各井穴可給予一編號。
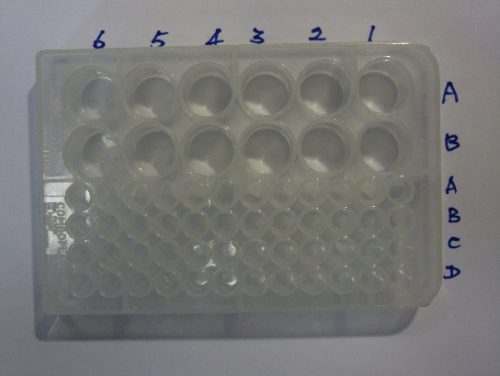
(圖 238) 矩陣式標籤有機Combo 井穴板
(i) sat. NaCl溶液
1. 準備一100 cm3燒杯半載sat. NaCl溶液,另外三個100 cm3燒杯各裝半滿去離子水 (一個用來調移去離子水,三個實驗後作清洗用)。
2. 這部份實驗使用Combo井穴板之大井穴以利攪拌作用,小井穴不適宜攪拌用途。探頭同時用作攪拌棒。開啟電導傳感器,DMM選擇2000 mV檔,300 mV 「短路校正」 。
3. 在井穴陣A/1穴用一乾淨巴斯德移液管注入40滴 NaCl溶液,A/ 2穴35滴,A/ 3穴30滴,A/ 4穴25滴,A/ 5穴20滴,A/ 6穴15滴,B/6穴10滴,B/5穴5滴。
4. 用一乾淨巴斯德移液管向A/2穴注入5滴去離子水,A/3穴10滴,A/4穴15滴,A/5穴20滴,A/6穴25滴,B/6穴30滴,B/5穴35滴。
5. 以上方法叫作「連續變化法」(continuous variation method) 。方法之特點是有目的地保持總容積不變,即40滴。加入之去離子水令濃度以 7/8:6/8:5/8: 4/8:3/8:2/8:1/8 遞減。若總容積有變,濃度不會以線性下降,每次都要計算一次。
6. 放探頭入A/1井穴,稍作攪拌,停止攪拌,置探頭於井穴底。等候至DMM顯示穩定,記錄數據。以去離子水清洗探頭三次。
7. 重複步驟 6,測量A/2,A/3,A/4,A/5,A/6,B/6,B/5井穴溶液電導率。
8. 以100 mV 「短路校正」,重複步驟 1 – 7並記錄各井穴溶液電導率 (表4)。
完成 (表4):
大井穴排名 | A/1 | A/2 | A/3 | A/4 | A/5 | A/6 | B/6 | B/5 | |
溶液 | sat. NaCl滴數 | 40 | 35 | 30 | 25 | 20 | 15 | 10 | 5 |
去離子水滴數 | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | |
DMM 顯示/mV | 300 FS | 185 | 190 | 188 | 186 | 182 | 179 | 169 | 146 |
100 FS | 62 | 63 | 63 | 62 | 61 | 60 | 56 | 49 | |
(ii) 1 M NaCl溶液
1. 重複 (i) sat. NaCl溶液實驗所有步驟,以1 M NaCl溶液取代sat. NaCl溶液。
2. 完成下表 (表5) :
(表5) :
大井穴排名 | A/1 | A/2 | A/3 | A/4 | A/5 | A/6 | B/6 | B/5 | |
溶液 | 1 M NaCl滴數 | 40 | 35 | 30 | 25 | 20 | 15 | 10 | 5 |
去離子水滴數 | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | |
DMM 顯示/mV | 300 FS | 157 | 149 | 142 | 135 | 128 | 116 | 92 | 73 |
100 FS | 52 | 50 | 47 | 45 | 43 | 39 | 31 | 24 | |
(iii) 100% CH3COOH
重複 (ii) 1 M NaCl溶液實驗所有步驟,以100% CH3COOH取代1 M NaCl溶液。特別注意:100% CH3COOH發出極強烈刺激氣味,一定要戴上醫療用口罩。不能讓有氣管敏感學生進行這實驗 。實驗 (iii) 涉及共價鍵化合物,電導率遠小於離子鍵電解質,傳感器輸出要調校至 300 mV 「短路校正」 。
完成 (表6) :
大井穴排名 | A/1 | A/2 | A/3 | A/4 | A/5 | A/6 | B/6 | B/5 | |
溶液 | 100% CH3COOH滴數 | 40 | 35 | 30 | 25 | 20 | 15 | 10 | 5 |
去離子水滴數 | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | |
DMM 顯示/mV | 300 FS | 2 | 2 | 10 | 14 | 21 | 22 | 22 | 18 |
(iv) 1 M CH3COOH
重複 (iii) 100% CH3COOH實驗所有步驟,以1M CH3COOH取代100% CH3COOH。1M CH3COOH會揮發食用醋氣味,仍要配戴口罩。實驗 (iv) 也涉及共價鍵化合物,電導率也小於離子鍵電解質,傳感器輸出仍需調校至 300 mV 「短路校正」 。
完成 (表7) :
大井穴排名 | A/1 | A/2 | A/3 | A/4 | A/5 | A/6 | B/6 | B/5 | |
溶液 | 1 M CH3COOH滴數 | 40 | 35 | 30 | 25 | 20 | 15 | 10 | 5 |
去離子水滴數 | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | |
DMM 顯示/mV | 300 FS | 18 | 17 | 16 | 15 | 14 | 12 | 9 | 8 |
(vi) 圖解結果
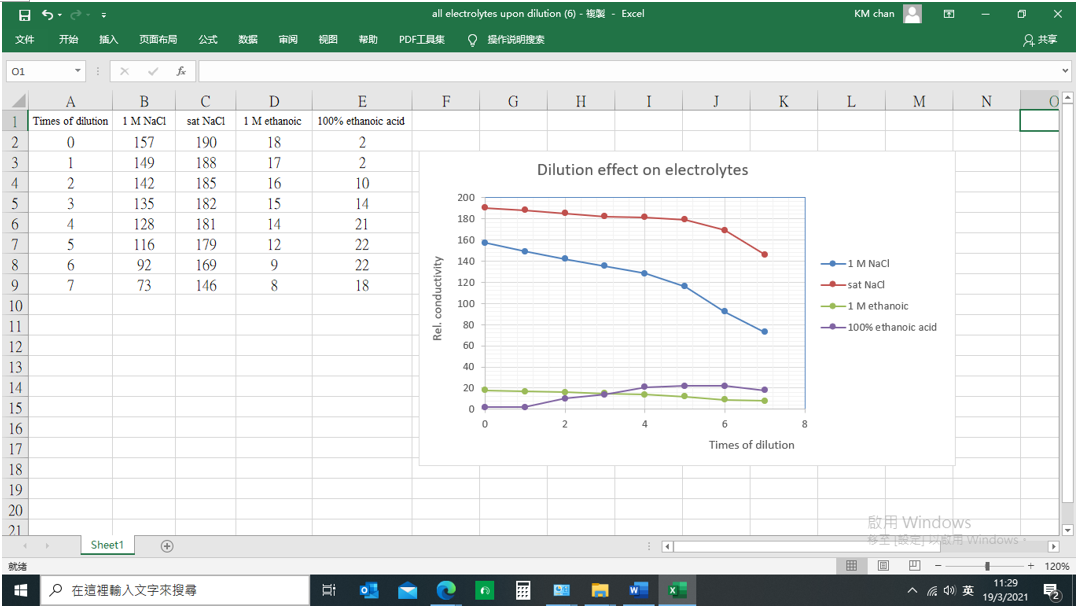
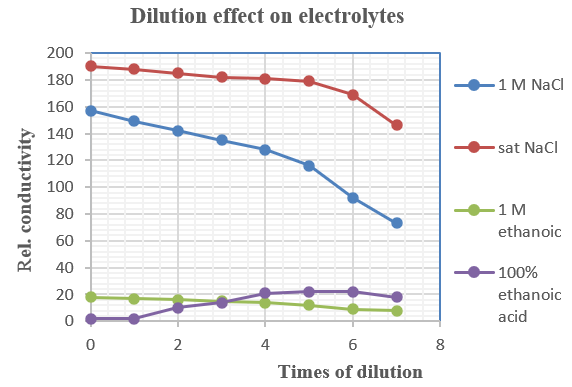
實驗 (i) 至 (iv) 之表格數據可以圖表形式表達。首先啟動微軟「Excel」。分別建立1M NaCl、 sat. NaCl、 1 M ethanoic acid 和 100% ethanoic acid各欄。從主菜單單擊「Insert」,跟着「Graph」。選擇「X-Y scattered diagram」。整理各軸和各座標,建強電電解質和弱電電解質之電導率與稀釋關係圖表 (下圖) 。
(vii) 總結
1. 電解質能於水中離子化 (ionize) 。例如氯化鈉、硫酸,乙酸、氨水等。
2. 非電解質溶液不會離子化 (non-ionizable) 。例如去離子水、葡萄糖,乙醇等。
3. 在同一條件下,強電解質水溶液電導率較弱電解質水溶液電導率為大。
4. 一般情況下,稀釋令電導率下降。但有些可溶於水之非電解質共價鍵化合物如100%乙酸,電導率隨稀釋而上升 (表6) 。這是因為有些可溶共價鍵化合物於水中離子化。
5. 遊離離子令溶液電導。
(viii) 討論
(1) 試列兩因素決定溶液電導。
離子和交/直流電
(2) 兩因素之動態應如何?
遊離和移動中
(3) 自由電子令固態電導體電導。遊離離子令水溶液電導。試列固態電導和溶液電導兩重要工業應用。
電動機和電解
(ix) 網頁搜尋
1. 連接互聯網,試找一合理解釋為什麼溶液電導不靠一串移動電子。
網址: | |
資料 | 基本概念 (1) 透過移動離子,直流電通過電解質溶液令電解質分解和使離子釋出或接收電子。 (2) 交流電通過電解質溶液不需要移動離子,沒有伴隨任可化學反應。 (3) 電解質溶液交流電通電運作相當一「推–挽」式機制。因兩電極受交流電電場 (正半週 /負半週電壓以一定頻率交替變動) 影響,電解質溶液之 (+)和 (-)離子於兩電極間不停振動。當一電極處於正半週時,另一電極處於負半週,以電壓頻率通電。設處於正半週一電極釋放 (push) 電子,另一電極處於負半週則接收 (pull) 電子,電子透過振動之不遷移 (+)和 (-)離子鏈通行。 (4) 電解質溶液通電不可以由移動電子 (即水合電子,hydrated electrons) 完成,因水合電子不可能產生。 |
2. 試解釋濃度和「有效濃度」或「活度」”activity”, a, 之差別。
「活度」(activity,a) 變數用於量度非理溶液 (non-ideal solution) 之有效濃度。當濃度為稀釋時,溶液濃度可作為量化溶液溶質之密度。高溶液濃度情況不一樣,溶液之溶質 (或電解質之離子) 自由度減少,只有一部份溶質可依反應方程式以化學計量 (stoichiometric) 計算。電解質溶液之有效濃度十分敏感,因溶液有 (+)和 (-)離子,高溶液濃度往往不能依反應化學計量計算。因此高濃度電解質溶液應以「活度」計算相關反應變數。
我們習慣用方程式 pH = – log [H+] 計算 pH值。但pH計是量度H+離子之有效濃度,因此嚴格地考慮,計算pH值應用方程式 pH = – log [aH+]。不過中學化學科程度計算pH值以pH = – log [H+] 計算也可接受。
「活度」概念涉及高階熱化學熱力學參數如化學位能 (chemical potential)、離子强度 (ionic strength)、吉布斯自由能 (Gibbs free energy)。簡而言之,就是針對非理想環境中之實體變数。v
實驗 (22): 微型電導滴定
(i) 實驗目的
1. 進行微型酸/鹼電導滴定
2. H2SO4(aq) vs Ba(OH)2(aq) 電導滴定測定硫酸溶液樣本濃度
(ii) 簡介
電導滴定是一種化學容量分析方法測定溶液濃度。共價水份子是酸鹼滴定反應一個產物,因此滴定起始時總離子濃度下降,當一方反應物用罄時,不再產生水份子,加入之另一離子反應物使電導率上升。整個滴定曲線為一落一上,產生之轉折點叫作「當量點」(equivalence point) 或「終點」,代表酸鹼中和反應計量完成 (stoichiometrically completed)。若錐瓶內反應物濃度已知,滴管內未知濃度反應物可從當量點和反應方程式計算其濃度。
有一點要注意:稀釋電解質溶液令電導率下降。加滴定劑 (titrant) 除了進行酸鹼反應之餘也起了稀釋作用,因此實驗完畢後之容積和實驗前之容積不應有太大差別。基於此原因,一般電導滴定都把滴定劑濃度和被滴定劑濃度比例定為10:1,使容積變化不會過大。不過這做法是有條件的:即反應方程式反應物計量系數為1:1。
(iii) 安全措施
配戴安全護鏡,不要讓皮膚接觸任何化學藥物。儘量用最少份量反應物料。按老師指示處理實驗步驟,化學藥物,過量物料和反應剩餘物。 |
|
(iv) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
* ~ 1 M H2SO4 | 100 cm 3 | 微型電導探頭 | 1 |
* 0.01 M Ba (OH)2 | 100 cm 3 | 電導傳感器 | 1 |
酚酞指示劑 | 5 cm3 | 10 cm3移液管 | 1 |
去離子水 | 適量 | 50 cm3滴定管 | 1 |
| 150 cm3 錐形瓶 | 2 | |
24井穴板或 combo 井穴板 | 1 | ||
巴斯德移液管 | 2 | ||
100 cm3 燒杯 | 5 | ||
DMM | 1 | ||
100 cm3 容量瓶 | 1 | ||
微型塑膠移液管 | 1 | ||
攪拌玻璃棒 | 1 | ||
砂紙 | 1小塊 | ||
*
(v) 實驗步驟
1. 準備三個乾淨100 cm3燒杯,各裝半滿去離子水,作清洗用。
2. 利用100 cm3容量瓶,把10 cm3樣本 ~ 1 M H2SO4製成100 cm3 ~ 0.1M H2SO4。用一100 cm3燒杯儲備稀釋之~ 0.1M H2SO4。
3. 準備一乾淨24井穴板,用一清潔巴斯德移液管注50滴0.01M Ba(OH)2(aq) 於其中一個井穴,隨著加2滴酚酞指示劑。
4. 開啟電導傳感器,連接DMM,選擇 2000 mV滿檔。以一金屬線 「短路校正」, 傳感器旋鈕調校至 DMM顯示 200 mV,跟着固定下來 (圖239)。
5. 置微型探頭於反應井穴,攪拌一會兒。停止攪拌並讓探頭尖置於井穴底 (圖240)。重複操作直至DMM顯示穩定,並記錄數據 (表1)。細看電解是否發生 (圖241)。
6. 用一清潔巴斯德移液管,加一滴 ~ 1 M H2SO4 於反應井穴。攪拌一會兒,停止攪拌並讓探頭尖置於井穴底。重複操作直至DMM顯示穩定 (圖242),並記錄數據。
7. 用同一巴斯德移液管,加第二滴 ~ 0.1 M H2SO4。重複步驟 (6) 。
8. 重複實驗直至加至10滴 ~ 0.1 M H2SO4。留意過「當量點」時顏色之突變。
9. 完成 (表1)。
(表 1):
大約0.1M H2SO4滴數 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
電導率 (FS 200 mV) | 27 | 24 | 20 | 16 | 12 | 9 | 20 | 28 | 35 | 40 | 45 |
Ba(OH)2(aq) + H2SO4(aq) → BaSO4(s) + 2H2O(l)
達致「當量點」時,井穴顏色由 ___________ 變為 ______________。
(圖239) 200 mV 「短路校正」 | (圖240) 置探頭尖於井穴底 |
(圖241) 探頭尖沒有電解現象 | (圖242) 滴定進行中,相對電導率為34% |
(vi) 數據處理
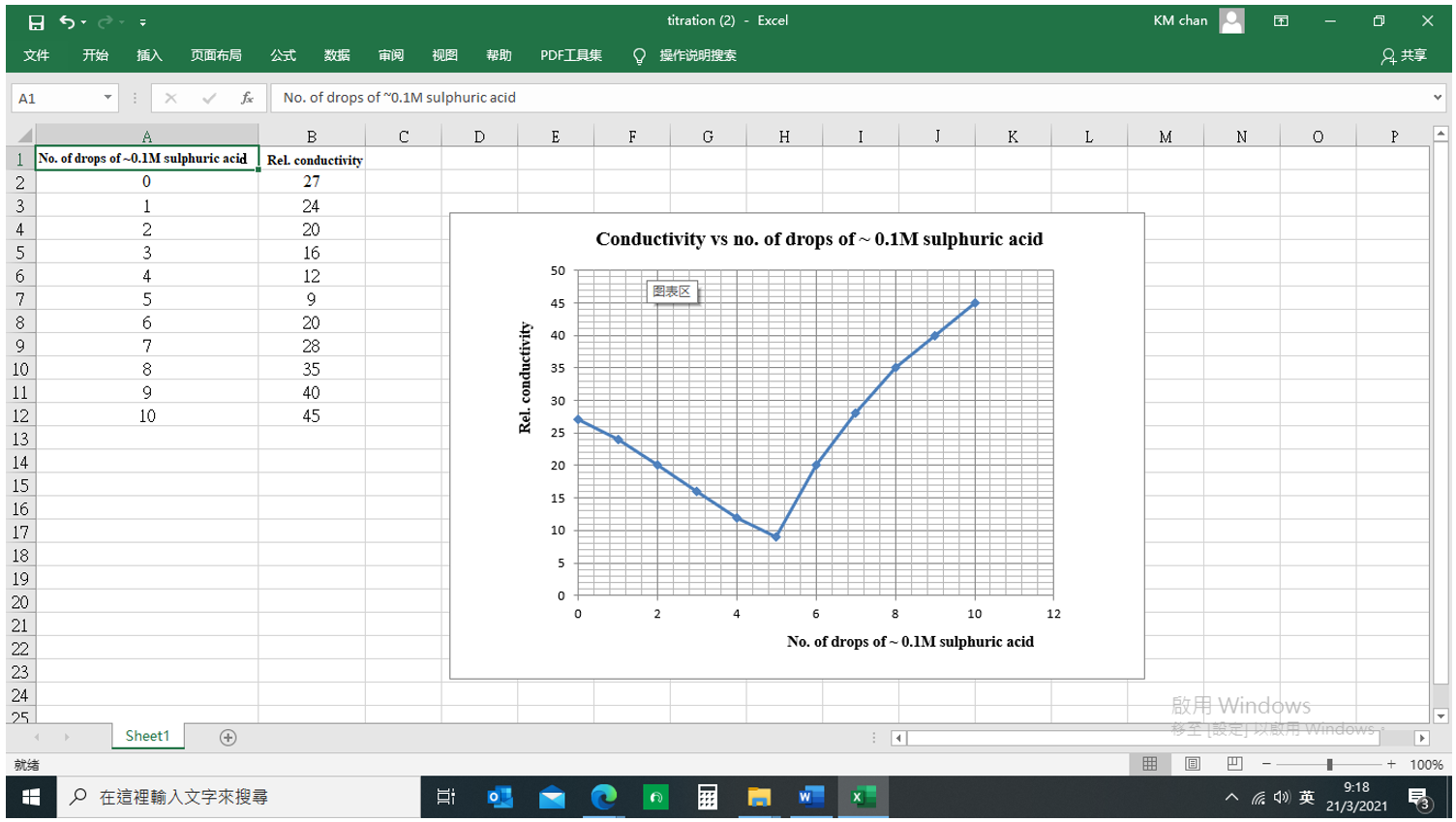
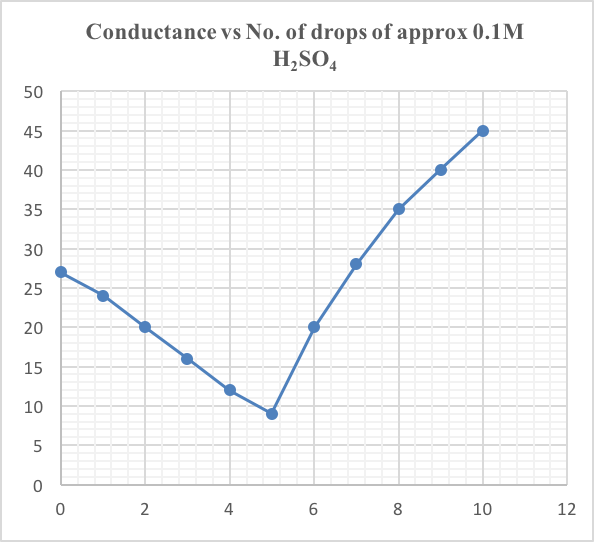
啟動「Excel」試算表軟件。建立 Rel. Conductance 和No. of drops of ~ 0.1M H2SO4 欄格。主頁菜單單擊「插入」,跟着「圖表」圖標。選擇「X-Y scattered diagram」。理順各坐標軸並建立電導滴定圖表。
(vii) 電導滴定曲線
檢視上圖,「當量點」為5.0 滴硫酸。
(viii) 計算
按反應計量計算,從反應方程式顯示,一摩爾酸中和一摩爾鹼。設x cm3 = 每滴容積,C mol dm-3 = 硫酸濃度。C之值計算如下:

(ix) 討論
1. 簡釋滴定初時有白色沉澱物產生。
巴斯德移液管加入之硫酸和井穴之Ba(OH)2溶液反應產生白色不溶於水之BaSO4(s) 。
Ba2+(aq) + SO42-(aq) → BaSO4(s)
2. 簡釋滴定曲線前段之斜率較過當量點後之斜率為小。
以200 mV FSD短路校正,0.01 M Ba(OH)2 相對電導率為27而0.01 M H2SO4 相對電導率為 58。H2SO4(aq) 電導率較Ba(OH)2(aq) 為大。
滴定開始時只有Ba2+(aq) 和 OH–(aq) 離子導電。加入每滴H2SO4(aq) 全部變為不電導之BaSO4(s) 和 H2O(l)。反應井穴內Ba2+(aq) 和 OH–(aq) 離子減少,電導率因此下降。達到當量點時,井穴內再沒有Ba2+(aq) 和 OH–(aq) 離子,而繼續加入之高電離度H2SO4(aq) 令電導率攀升。
3. 簡釋滴定曲線不是兩直線。
參考第51頁 (圖 145和 146) 可見微型探測器兩端建立之電場不是平行直線形而是曲線形。因此當離子濃度改變時,電導率不是作比例性地線性改變。再者,過當量點後稀釋效應也影響線性改變。
4. 最精準容量分析方法可以測定最小溶液濃度達至何種程度?若要測定更小溶液濃度有什麼方法?
滴定法 (Titration) 測定溶液濃度精準度可達至10-4 M,庫倫法(Coulometry)可測至10-5 M等。要測定10-6 – 10-8M溶液濃度要用精密儀器如原子吸光儀 (Atomic Absorption Spectrometer)
5. 對比傳統用滴管和錐形瓶之滴定法,試列兩 個使用井穴板和巴斯德移液管微型滴定法主要優點。
(i) 反應量少和 (ii) 以整數滴數代替有小數位之容積數據,即以計數代替量度。
6. 建議 兩個 主要實驗誤差。提議解決方法。
實驗誤差 | 解決方法 |
(i) 滴與滴之容量誤差 | 用同一巴斯德移液管和同一傾斜角度,手指壓力要均勻。 |
(ii) 當量點容易被超越 | 要靠圖解曲線定轉折點,不應只計滴數。 |
(x) 結論
提供之硫酸樣本經微型電導滴定測定為1.00 mol dm-3
實驗 (23) : 比色計測量 KMnO4濃度
(i) 實驗目的
1. 目視估測KMnO4溶液樣本度濃度
2.用比色計則定KMnO4溶液樣本濃度
(ii) 簡介
(A) 人類雙眼是一台天然比色計
人類雙眼視覺可分辨物體距離和立體程度 (對光波相位差敏感) 和有色液體顏色之深淺 (對光波波幅敏感)。因此眼睛是一台優良天然比色計,若有一順列試管1,2,3…至10,內裝顏色溶液其濃度有遞減作為一測試板,那麼我們依靠雙眼可以估算未知濃度有同樣顏色之溶液。只要用它來對照測試板,如果它的顏色深淺近似試管4,那麼它的濃度可視作是試管4之濃度。
這方法缺點甚多。雖然如此,方法代表了最基本的比色法。若要準確量化測試光度就要使用儀器 – 比色計 (colorimeter)。
(B) 用比色計則定有色溶液樣本度濃度
(A) 之情況可以用比色計得到準確定量數據。比色計圖解校正法可測量任何有顏色溶液樣本度濃度。比色計量度溶液之透光率 (回顧主題 5.3) 。只要用已知濃度溶液之透光率與濃度作一校正曲線 (圖243),未知溶液X之濃度可從透光率校正曲線推斷出來。校正曲線不會是一直線。
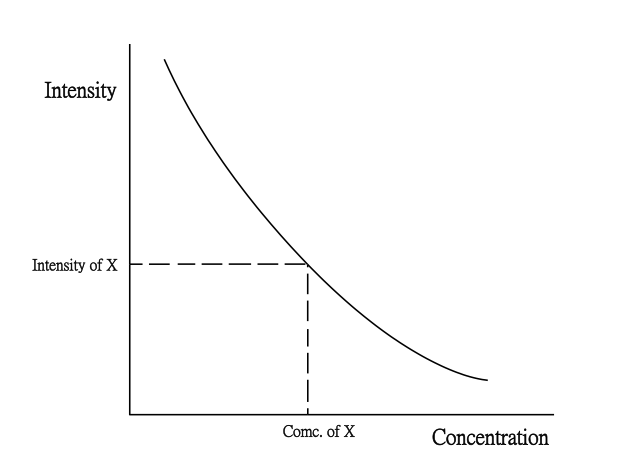
(圖243) 比色計校正曲線
(iii) 安全措施
配戴安全護鏡,不要讓皮膚接觸任何化學藥物。儘量用最少份量反應物料。按老師指示處理實驗步驟,化學藥物,過量物料和反應剩餘物。 |
|
(iv) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
4 x 10-3M KMnO4 | 25 cm3 | 自製比色計連插線 | 1 |
Solution X | 15 cm3 | DMM | 1 |
去離子水 | 適量 | 大塑膠移液管 | 4 |
10 cm3 移液管 | 2 | ||
試管 | 10 | ||
250 cm3燒杯 | 1 | ||
玻璃棒 | 1 | ||
洗滌瓶內裝去離子水 | 1 | ||
| 鑷子 | 1 |
(v) 實驗步驟
(A) 目視法估算KMnO4 溶液樣本濃度
1. 用10 cm3 移液管注20 cm3 4 x 10-3 M KMnO4 入試管 從試管1移10 cm3 4 x 10-3 M KMnO4入試管2,加相同容量去離子水入試管2,徹底攪拌。
2. 從試管2移10 cm3溶液入試管3,加相同容量去離子水,徹底攪拌。
3. 從試管3移10 cm3溶液入試管4,加相同容量去離子水,徹底攪拌。
4. 重複步驟3四次直至製備試管5,6,7和8。下表顯示製備溶液之濃度:
試管 | KMnO4溶液濃度 / x 10-4mol dm-3 |
1 | 40.00 |
2 | 20.00 |
3 | 10.00 |
4 | 5.00 |
5 | 2.5 |
6 | 1.25 |
7 | 0.625 |
8 | 0.3125 |
5. 把8試管排列成一排,以透明膠貼紙固定成一測試板 (圖244)。置溶液X靠近測試板,目測測試板中顏色深淺最匹配X的試管。溶液X之濃度就估算為測試板那試管之濃度。
 (圖244) 試管測試板
(圖244) 試管測試板
(B) 比色計則定KMnO4溶液樣本濃度
(i) 100%透光率空白校正
1. | DMM連接比色計,選擇DC 2000 mV 滿檔。 |
2. | 開啟比色計。選擇LED綠色光源 (520 nm)。 |
3. | 注去離子水入一清潔比色杯至3/4滿。 |
4. | 用鑷子把比色杯放入比色計杯槽。注意比色計杯之光面要對正光源和LDR。蓋上蓋子。 |
5. | 調校比色計旋鈕至DMM顯示100 mV。固定旋鈕,校正步驟完畢,儀器可以進行實驗。 |
(ii) 濃度測量
1. | 用膠移液管注40滴試管1溶液入一清潔比色杯。用乾淨紙巾清潔比色杯兩光面,放入比色杯槽至槽底。蓋上蓋子。記錄穩定數據。 |
2. | 用鑷子拿走比色杯,倒去溶液,完全清洗比色杯。注40滴試管2溶液入這比色杯。用乾淨紙巾清潔比色杯兩光面,放入比色杯槽至槽底。蓋上蓋子。記錄穩定數據。 |
3. | 重複步驟 (2) 直至試管3,4,5,6,7和8之溶液都完成實驗。 |
(iii) 實驗結果 (校正曲線)
試管 | KMnO4溶液濃度/ x 10-4mol dm-3 | DMM顯示(100 mV空白校正) |
1 | 40.00 | 4.7 |
2 | 20.00 | 9.5 |
3 | 10.00 | 17.4 |
4 | 5.00 | 39.5 |
5 | 2.5 | 68.1 |
6 | 1.25 | 85.3 |
7 | 0.625 | 93.1 |
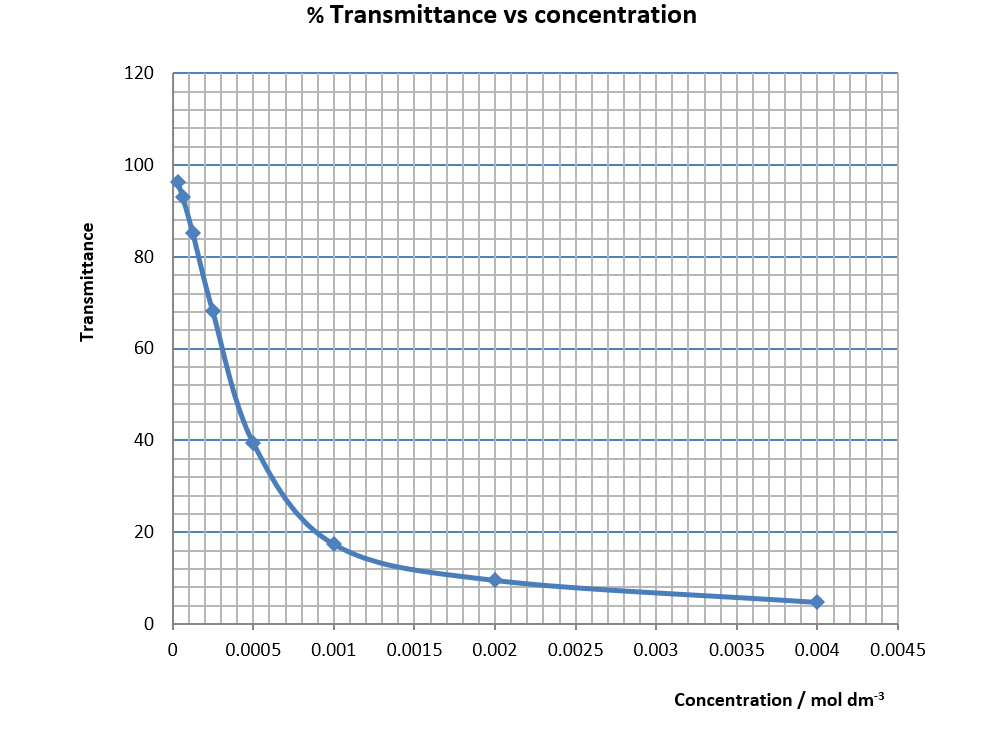
8 | 0.3125 | 96.4 |
(圖245) 校正曲線數據
溶液X之DMM顯示 = ________________
(iv) 數據處理
啟動「Excel」試算表軟件。建立 Rel. Conductance 和No. of drops of ~ 0.1M H2SO4 欄格。主頁菜單單擊「插入」,跟着「圖表」圖標。選擇「X-Y scattered diagram」。理順各坐標軸並建立校正圖表。
(圖246) 校正曲線
從校正曲線推斷,以DMM顯示 _____,溶液X之濃度為 __________ mol dm-3
(vi) 討論
1. 對比色測試濃度而然,簡釋目測法是否科學?
若缺少定量儀器,目測法是科學方法之實用「嘗試錯誤法」 (trial-and-error method)
2. 除用比色計外,說出另一定量實驗方法測量有顏色溶液濃度。兩者準確度差別如何?

3. 以下討論有關比爾定律 (Beer’s law)
(a) 可否用計算方法而不用校正曲線推斷結果?
可以
(b) 如何作計算?
需要建立濃度與光度一方程式。
(c) 如何得知相關方程式?濃度與光度是線性相關或是其他函數相關?

(d) 試以比爾方程式按吸光度和溶液濃度作一圖解。從線性作圖推斷一直線方程,代入吸光度數據計算溶液濃度。
比爾定律不適用於高濃度和極低濃度溶液。(圖245)表格改寫為:
試管 | KMnO4溶液濃度/ x 10-4mol dm-3 | DMM顯示(100 mV空白校正) |
3 | 10.00 | 17.4 |
4 | 5.00 | 39.5 |
5 | 2.5 | 68.1 |
6 | 1.25 | 85.3 |
7 | 0.625 | 93.1 |
建立吸光度數據,濃度數據表格:
試管 | KMnO4溶液濃度/ x 10-4mol dm-3 | DMM顯示 (100 mV空白校正) | T (透光度,Transmittance) | 1/T | Absorbance Log (1/T) |
3 | 10.00 | 17.4 | 0.174 | 5.75 | 0.76 |
4 | 5.00 | 39.5 | 0.395 | 2.53 | 0.40 |
5 | 2.5 | 68.1 | 0.681 | 1.47 | 0.17 |
6 | 1.25 | 85.3 | 0.853 | 1.17 | 0.07 |
7 | 0.625 | 93.1 | 0.931 | 1.07 | 0.03 |
啟動 “Excel”試算表。輸入溶液濃度和吸光度數據,繪製 XY 散射圖。
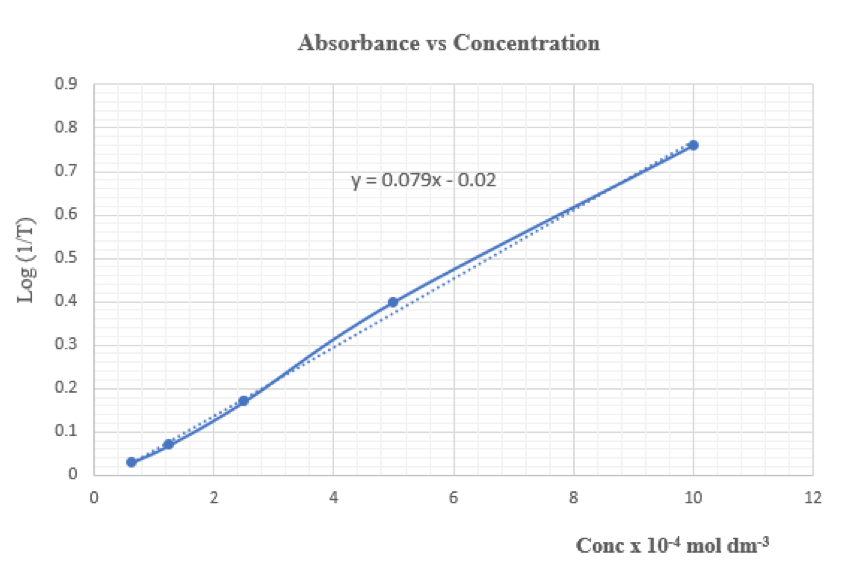
線性公式: 吸光度 = 0.079 (濃度 x 104 mol dm-3) – 0.02
上式代入吸光度可計算出濃度。
「DMM顯示技巧」只顯示透光度 (T),需要改寫上式為:

(e) 試以 “Excel” 試算表函數指令建立一計算方程,輸入未知吸光度 (T) 即時可得需求之濃度數據。

(圖247) “Excel” 試算表吸光度 (T) 和濃度對換函數指令公式和圖解
(vii) 結論
1. 從建立之校正曲線圖 (圖246),推斷溶液X之濃度為 __________________。
2. 從建立之 “Excel” 試算表函數公式(圖247),溶液X之濃度計算為 __________________。
實驗 (24) : 比色計測定不含酒精飲料的食物色素的含量
(i) 實驗目的
以「DMM 顯示技巧」測量不含酒精 “芬X”橙味飲品食物色素日落黃 (Sunset Yellow,E110) 的 ppm含量。
(ii) 簡介
食物色素往往加入包裝食物令其外表吸引消費者。如紅麴素(monascin)塗上叉燒便由燒烤式叉燒樣子變為鮮豔紅色。不過這些食用色素有嚴格監管和國際標準。標籤字母為E,如 (E 133) 食用藍色一號 (Brilliant Blue) 用於化妝品, (E110) 日落黃 (Sunset Yellow) 用於飲料等。
這些色素 (人工或天然) 水溶解度很高,少許溶于水便有強烈透明顏色,非常適合用比色計測量其溶液濃度。本實驗用 (E110) 日落黃色素作校正藥物,測試 “芬X” 橙味飲品含日落黃色素之濃度,以 ppm 單位顯示。1 ppm = 1 part per million, 若是溶液,1 ppm = 1 mg dm–3 。
(iii) 安全措施
本實驗之藥物和儀器全部都很安全。但要老師指導下在實驗室進行實驗。小心每一步驟。緊記「黃金規則」:先停2秒才開始。
(iv) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
200 ppm日落黃色(E 110) 溶液 | 25 cm3 | 自製比色計連插線 | 1 |
“芬X”橙味飲品,去二氧化碳 | 15 cm3 | DMM | 1 |
去離子水 | 適量 | 塑膠比色杯 | 3 |
| 巴斯德移液管 | 4 | |
100 cm3,250 cm3燒杯 | 各1 | ||
500 cm3 容量瓶 | 1 | ||
玻璃棒 | 1 | ||
微型玻璃棒 | 1 | ||
鑷子 | 1把 | ||
洗滌瓶內裝去離子水 | 1 | ||
刮勺 | 1 | ||
電子天秤 (±0.001克) | 1 | ||
(iv) 實驗步驟
| (A) | 製備日落黃 (E 110) 200 ppm 校正溶液 | ||||||||||||||||||||||||||||||||||||||||||
稱量0.100克日落黃色素,置入100 cm3燒杯,加去離子水並攪拌至全部溶解。移溶液入500 cm3容量瓶,加去離子水至半月灣面至刻線。上下倒轉反搖五次。製備之濃度為 200 ppm。取約100 cm3 200 ppm日落黃色素溶液作校正實驗儲備。 | |||||||||||||||||||||||||||||||||||||||||||
| (B) | 製備 “芬X” 橙味飲品樣本 | ||||||||||||||||||||||||||||||||||||||||||
“芬X” 橙味飲品內含二氧化碳氣體,不可以開瓶後即時用作實驗。以巴斯德移液管提取約10 cm3,置室內20分鐘,期間不時攪拌。 | |||||||||||||||||||||||||||||||||||||||||||
| (C) | 比色計藍色LED校正 | ||||||||||||||||||||||||||||||||||||||||||
| 1. | 啟動比色計,連接DMM,選擇2000 mV滿檔。調校旋鈕至DMM顯示100mV。注約50滴 “芬X” 橙味飲品入比色杯 (圖248),用鑷子把它全部放入比色槽倉,蓋上蓋子(圖249)。留意比色杯之透明面要對著三色LED光源和LDR光感電阻。用紙手巾清潔比色杯兩透明面。光源選擇旋鈕分別測試溶液對紅,綠和藍三種單色光之相對吸光度。決定藍光之吸光度最為優勝。 | ||||||||||||||||||||||||||||||||||||||||||
| 2. | 跟著要用藍光校正比計。取另一清潔比色杯,注入50滴去離子水,用鑷子把它全部放入比色槽倉,蓋上蓋子。謹記做足留意事項。調校旋鈕至DMM顯示100 mV (圖250)。校正步驟完畢,比色計可進行實驗。
| ||||||||||||||||||||||||||||||||||||||||||
| (D) | 比色計實驗 | ||||||||||||||||||||||||||||||||||||||||||
| (i) | 建立校正曲線推斷“芬X”橙味飲品日落黃色素濃度 | ||||||||||||||||||||||||||||||||||||||||||
a. | 取一清潔比色杯,注入50滴200 ppm日落黃色素溶液 (圖248),用鑷子把它全部放入比色槽倉,蓋上蓋子。謹記做足留意事項。記錄穩定DMM資料。 | ||||||||||||||||||||||||||||||||||||||||||
b. | 取另一清潔比色杯,注入40滴200 ppm日落黃色素溶液,跟著注10滴去離子水,用微型玻璃棒攪拌數圈。用鑷子把它全部放入比色槽倉,蓋上蓋子。謹記做足留意事項。記錄穩定DMM資料。 | ||||||||||||||||||||||||||||||||||||||||||
c. | 重複步驟 (b),日落黃色素溶液滴數:去離子滴數 30:20。 | ||||||||||||||||||||||||||||||||||||||||||
d. | 重複步驟 (b),日落黃色素溶液滴數:去離子滴數 20:30。 | ||||||||||||||||||||||||||||||||||||||||||
e. | 重複步驟 (b),日落黃色素溶液滴數:去離子滴數 10:40。 | ||||||||||||||||||||||||||||||||||||||||||
f. | 完成以下表格。
| ||||||||||||||||||||||||||||||||||||||||||
g. | 完成以下表格。
| ||||||||||||||||||||||||||||||||||||||||||
h. | 啟動 “Excel” 軟體,輸入步驟 (f) 表格資料,繪製XY散射圖 (濃度資料 vs 透光度(T) 資料,完成校正曲線圖 (圖 248) 。 | ||||||||||||||||||||||||||||||||||||||||||
i. | 按校正曲線,以步驟 (g) “芬X” 橙味飲品樣本之透光度數據,推斷 “芬X”橙味飲品含日落黃色素之 ppm 濃度。 | ||||||||||||||||||||||||||||||||||||||||||
| (ii) | 建立比爾定律校正線性圖,計算“芬X”橙味飲品日落黃色素濃度 | ||||||||||||||||||||||||||||||||||||||||||
a. | 按 (i) 步驟改寫 (f) 表格,輸入(1/T) 和 log(1/T) 數據。新表格如下:
| ||||||||||||||||||||||||||||||||||||||||||
b. | 利用 “Excel” 試算表繪製濃度vs log(1/T) 圖解,取得趨勢直線和相關線性公式。跟著用指示令編寫簡單程式。輸入透光度 (T) 和日落黃色素溶液ppm濃度。輸入未知透光度 (T) 可即時顯示其ppm濃度。 | ||||||||||||||||||||||||||||||||||||||||||
c. | 輸入 “芬X” 橙味飲品透光度 (T),即時以編寫程式求得 “芬X” 之日落黃色素ppm濃度。 |
(v) 實驗計算和結果
(i) 建立校正曲線推斷“芬X”橙味飲品日落黃色素濃度
1. 實驗結果:
日落黃色素溶液滴數 | 50 | 40 | 30 | 20 | 10 |
去離子水滴數 | 0 | 10 | 20 | 30 | 40 |
日落黃色素溶液濃度/ppm | 200 | 160 | 120 | 80 | 40 |
DMM顯示 /2000 mV | 13 | 15 | 20 | 27 | 36 |
透光度 (T) | 0.13 | 0.15 | 0.20 | 0.27 | 0.36 |
“芬X”橙味飲品滴數 | 50 |
DMM顯示 /2000 mV | 22 |
透光度 (T) | 0.22 |
b. 以 “Excel” 試算表取得日落黃色素ppm濃度 vs 透光度 (T) XY散射圖如下:
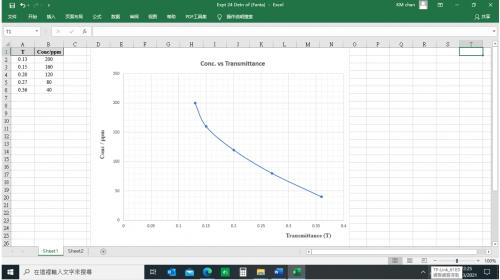
(圖251) 濃度 vs 透光度 (T) 校正曲線
c. 已知 “芬X” 橙味飲品透光度 (T) 為0.22,從上圖可推斷日落黃色素ppm濃度為 105 ppm。
(ii) 建立比爾定律校正線性圖,計算“芬X”橙味飲品日落黃色素濃度
a. 建立一新「Excel」試算表和 (T) 、1/T及log(1/T) 欄並輸入相關資料。因比爾定律不適用太稀釋溶液,所以除去40 ppm日落黃色素濃度之相關資料。建立濃度vs 吸光度 (T) XY散射曲線和趨勢 (圖252),取得線性公式。
b. 實驗結果:
日落黃色素溶液滴數 | 50 | 40 | 30 | 20 | 10 |
去離子水滴數 | 0 | 10 | 20 | 30 | 40 |
日落黃色素溶液濃度/ppm | 200 | 160 | 120 | 80 | 40 |
DMM顯示 /2000 mV | 13 | 15 | 20 | 27 | 36 |
透光度 (T) | 0.13 | 0.15 | 0.20 | 0.27 | 0.36 |
1/T | 7.69 | 6.67 | 5.00 | 3.70 | 2.78 |
Log (1/T) | 0.89 | 0.82 | 0.70 | 0.57 | 0.44 |
c. 取得之線性方程式:
濃度 (ppm) = 363.03 log (1/T) – 130.34
Conc/ppm一欄對應 (T) 欄為 A 10之 D 10空格建立以 “Excel” 指令編寫程序:
=SUM(-130.24,363.03*(PRODUCT(LOG10(1/A10))))
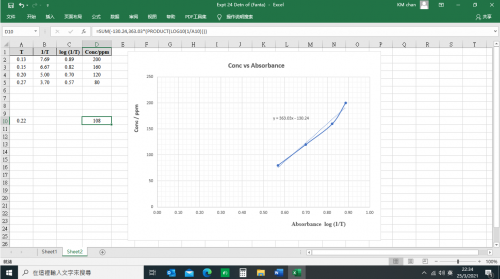
(圖252) 濃度 vs 吸光度XY散射曲線和趨勢直線
d. A 10空格輸入 0.22便得 D 10空格顯示108 ppm。
e. “芬X”橙味飲品日落黃色素濃度計算為108 ppm。
(vi) 結論
1. 以校正曲線推斷 “芬X” 橙味飲品日落黃色素濃度為 105 ppm。
2. 以 “Excel” 試算表線性計算 “芬X” 橙味飲品日落黃色素濃度為 108 ppm。
實驗 (25) : 測試 (酸化過氧化物氧化碘離子之化學反應) 碘離子之反應級數
(i) 實驗目的
驗證假設酸化過氧化氫氧化碘離子反應對碘離子應為一級反應。
(ii) 資料簡介
(A) 理論角度考慮
(i) 酸化過氧化氫氧化碘離子反應方程式:
H2O2(aq) + 3I-(aq) + 2H+(aq) → I3-(aq) + 2H2O(l)
通常以簡化式表達:
H2O2(aq) + 2I-(aq) + 2H+(aq) → I2(aq) + 2H2O(l)
選作測量用的反應物是深棕色I3–(aq) 離子產物。有色溶液產物十分適宜以比色計測量其濃度。全部I–(aq) 離子反應生成I3–(aq),但不能用過量H2O2(aq) 。 因為生成之I3–(aq) 會氧化為灰黑色I2沉澱,令比色計不能進行實驗。

總反應速率決定於速率控制步驟 (rate determining step),即慢反應之第一基元反應 (elementary reaction)。以計量系數考慮第一基元反應,總反應對碘離子和過氧化氫之反應級數都為1。
實驗之化學反應方程碘離子計量系數為2,不是1。因此有需要測定碘離子之反應數。
(ii) 實驗方法是檢視反應衰變曲線 (decay curve) 之半衰期 (half-life) 。按積分式一級反應速率方程:
[A] = [A]o e-kt
當碘離子反應物被消耗,即衰變,至其濃度一半時: [A] = 1/2[A]o, 反應速率方程半衰期, [A]/[A]o = e-kt1/2,
– ln 2 = – k t1/2
t1/2 = ln 2/k ,為一常數。
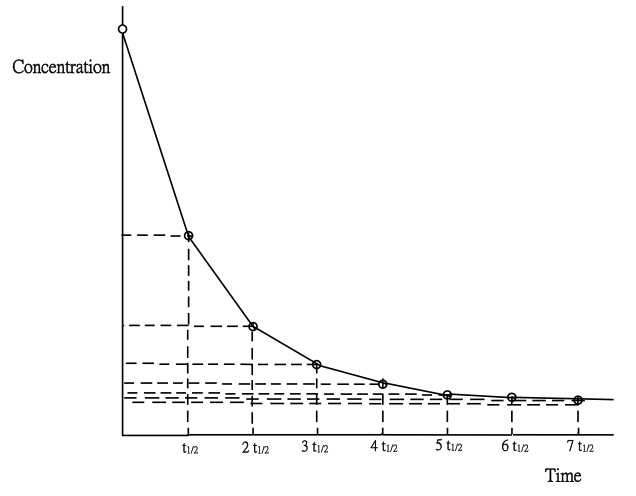
(圖253) 顯示連續半衰期之一級反應衰變曲線圖
(圖253) 顯示各半衰期非常近似一常數,所以上圖之反應物反應級數為1。
(B) 實驗角度考慮
實驗儀器採用本課程設計之比色計結合「DMM顯示技巧」。儀器只顯示透光度 (Transmittance, T)。空白校正 DMM顯示 100% 透光,或 T = 1.00。當有I2(aq) 或I3–(aq) 離子生成時,比色杯內透明溶液開始變淺棕色,跟着變深棕色。DMM顯示 100 mV開始下降,初時下降速率快,跟著慢下來。反應物濃度不會用作計算,只要濃度能起吸光作用便可以了,不能太濃,也不可以太稀。目的是繪製反應物碘離子之衰變曲線,從而求得數個半衰期時間。
(iii) 安全措施
配戴安全護鏡,不要讓皮膚接觸任何化學藥物。儘量用最少份量反應物料。按老師指示處理實驗步驟,化學藥物,過量物料和反應剩餘物。 |
|
(iv) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
* 0.6 M KI | 10 cm3 | 自製比色計連插線 | 1 |
* 1 M H2SO4 | 10 cm3 | DMM | 1 |
3% H2O2 | 10 cm3 | 塑膠比色杯 | 3 |
去離子水 | 適量 | 巴斯德移液管 | 4 |
| 100 cm3 和250 cm3燒杯 | 各1 | |
微型玻璃棒 | 1 | ||
洗滌瓶內裝去離子水 | 1 | ||
秒錶 | 1 | ||
鑷子 | 1把 | ||
保護膠手套 | 1對 | ||
*
(v) 實驗步驟
(A) 置滿度 (即 100 mV) 空白校正
1. 啟動比色計,連接 DMM,選擇 2000 mV 滿檔。
2. 選擇綠色單色LED光源。
3. 裝填清潔比色杯去離子水至3/4滿。用紙巾抹乾兩面透明面。
4. 用鑷子夾著比色杯,放下比色杯槽倉至底部,留意單色光要穿過透明面,蓋上蓋子。
5. 調校旋鈕至DMM顯示 100 mV。固定旋鈕,校正步驟完畢,可以進行實驗。
(B) 動力學測試一級反應
1. | 分別用清潔巴斯德移液管滴 4滴 0.6M KI溶液入一清潔比色杯,跟着再滴 5滴 1M H2SO4溶液和35滴去離子水,用微型玻離棒攪伴數圈。 |
2. | 戴上保護膠手套。小心加1滴3% H2O2 溶液,用手覆蓋比色杯口,上下搖動三次。用紙巾抹乾兩面透明面,快速放入比色杯槽倉,蓋上蓋子。同一時間用秒錶計時。 |
3. | 記錄DMM電壓數據,完成表 (2)。 |
各溶液混合一覽表:(表 1)
反應物 | 滴數 | 備註 |
0.6 M KI | 4 | 不一定是4滴,只要令半衰期時間不太短或過長。適宜t1/2約200s |
1 M H2SO4 | 5 | 質量要過量 |
3% H2O2 | 1 | 滴數不能太多,否則過量會產生碘沉澱,影響透光度。 |
去離子水 | 35 | 可調校至一合適反應速率。 |
(vi) 實驗數據:(表 2)
時間 / s | DMM顯示 / 2000 mV | 時間 / s | DMM顯示 / 2000 mV |
0 | 100 | 660 | 34 |
15 | 97 | 720 | 32.5 |
30 | 94 | 780 | 31.5 |
45 | 91 | 840 | 30.5 |
60 | 88 | 900 | 29.5 |
75 | 85.5 | 960 | 29 |
90 | 83 | 1020 | 28 |
105 | 81 | 1080 | 27.5 |
120 | 78 | 1140 | 27 |
150 | 73.5 | 1200 | 26 |
180 | 69 | 1260 | 26 |
210 | 65 | 1320 | 25.5 |
240 | 62 | 1380 | 25 |
270 | 58 | 1440 | 25 |
300 | 55 | 1500 | 24.5 |
360 | 49.5 | 1560 | 24 |
420 | 45 | 1620 | 24 |
480 | 41.5 | 1680 | 24 |
540 | 38.5 | 1740 | 24 |
600 | 36 | 1800 | 24 |
(vii) 數據處理
啟動 “Excel” 試算表軟件,輸入時間和透光率數據。繪製XY散射曲線。估算第1、2、3和4半衰期之時間。
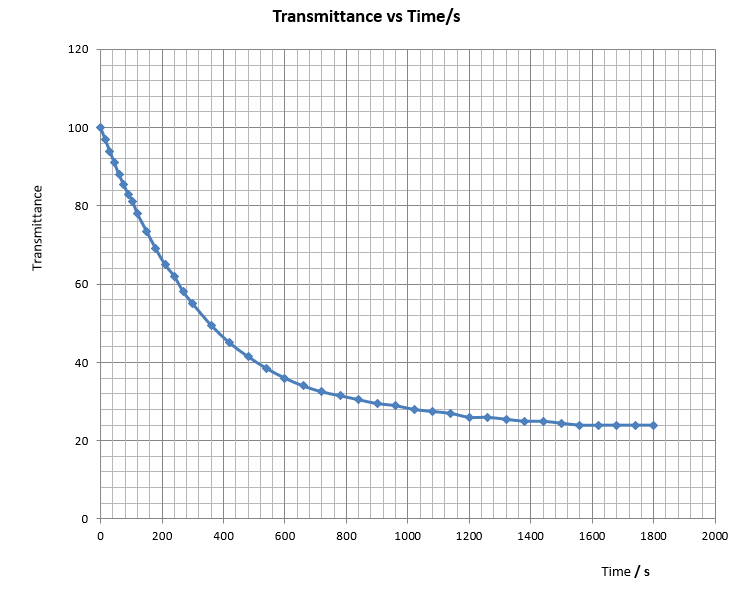
實驗全程透光率幅度 = (100 – 24) = 76
第一半衰期透光率由100下降至 [100 – (76/2)] = 62。所需時間為 230 s
第二半衰期透光率由62下降至 [62 – (62 – 24)/2] = 43。所需時間為 460 s
第三半衰期透光率由43下降至 [43 – (43 – 24)/2] = 35。所需時間為 690 s
第四半衰期透光率由35下降至 [35 – (35 – 24)/2] = 29。所需時間為 970 s
半衰期 | 時間 / s | 連續半衰期之間時間差別 / s |
第1 | 230 | 230 |
第2 | 460 | (460 – 230) = 230 |
第3 | 690 | (690 – 460) = 230 |
第4 | 960 | (960 – 680) = 280 |
第一、二和三半衰期時間平均為230 s。自第四半衰期開始,第五和第六半衰期時間數據誤差大,不可接受。
(viii) 結論
透過半衰期驗視法,假設酸化過氧化氫氧化碘離子反應對碘離子應為一級反應是對的。
(ix)
1. 實驗測量之變數反應物是消耗之碘離子或是生成之碘?
碘離子無色,對比色計不起作用。生成之碘會即時變為棕色絡離子(complex ion) I3–(aq) 令溶液由無色變為棕色。實驗測量之變數反應物是生成之碘。
2. 簡釋不用測量實質生成碘之濃度。
不論起始反應物濃度多少,衰變曲線都會形成。. 所以不需知道起始碘離子濃度,也不需知道生成碘之濃度。
3. 測量結果之半衰期是否一個常數?
實驗結果得出量度之頭三個半衰期時間都是一樣,反應半衰期是一個常數。
4. 試解析反應是否對碘離子是一級反應。
因消耗碘離子半衰期為一常數,所以反應物碘離子之反應級數是1。
5. 簡單陳述 另一 實驗方法驗證本實驗目的。.
除了用比色計,也可用這一方:限制反應生成一固定份量之碘,並測研改變反應物濃度對生成此份量碘之影響。這方法就是有名之「碘時鐘反應」。這方法之關鍵反物是加少量一定份量硫代硫酸鈉 (消耗碘) 和澱指示劑 (顯示碘出現)。當溶液突然出現深藍色時即表示那一定份量硫代硫酸鈉耗盡,開始產生之碘令澱指示劑變深藍。若碘離子濃度增加一倍而出現深藍時間則減半,便證明碘離子對反應級數為1,参閱實驗 (11)。
6. 按反應方程式H2O2(aq) + 2I–(aq) + 2H+(aq) → I2(aq) + 2H2O(l),碘離子計量系數為2,為什麼反應物碘離子之反應級數不是2而是1呢?
化學反應方程之各反應物計量系數 (stoichiometric coefficient) 是用作計算需要多少反應物和產生多少產物。上式表示1摩爾H2O2(aq),2摩爾I–(aq) 和2摩爾H+(aq) 反應,產生1摩爾I2(aq) 和2摩爾H2O(l)。計量系數純粹用作計算反應產生多少產物。計量系數和反應速率沒有關係。
反應級數則和反應速率相關,不可以從反應方程式得知,一定要從實驗測定。上式從實驗得知增加I2(aq) 濃度一倍,反應速率也增加一倍,所以反應物碘離子之反應級數是1,不是2。
計量系數 (stoichiometric coefficient) 和反應級數 (kinetic order) 是兩回事。
7. 不用衰變曲線法,可否另一方法,證明反應物碘離子之反應級數是1。
按積分式一級反應速率方程式:
[A] = [A]o e-kt
ln [A] = ln[A]o – kt
ln([A]o/[A]) = kt
以 ln([A]o/[A]) 對 t作圖,應得一斜率直線通過 XY軸 (0 0) 點。
以「DMM顯示技巧」,本實驗之 [A]o 為100,[A] 為DMM顯示。因此直線通過XY軸 (0, 0) 點。因第一,二和三半衰期時間接近常數,即 230 s,而後來之半衰期時間誤差大,所以碘離子衰變180秒後資料棄用。
[A] | [A]o | [A]o/[A] | ln([A]o/[A]) | 時間 / s |
100 | 100 | 1.00 | 0.00 | 0 |
97 | 100 | 1.03 | 0.03 | 15 |
94 | 100 | 1.06 | 0.06 | 30 |
91 | 100 | 1.10 | 0.10 | 45 |
88 | 100 | 1.14 | 0.13 | 60 |
85.5 | 100 | 1.17 | 0.16 | 75 |
83 | 100 | 1.20 | 0.18 | 90 |
81 | 100 | 1.23 | 0.21 | 105 |
78 | 100 | 1.28 | 0.25 | 120 |
73.5 | 100 | 1.36 | 0.31 | 150 |
69 | 100 | 1.45 | 0.37 | 180 |
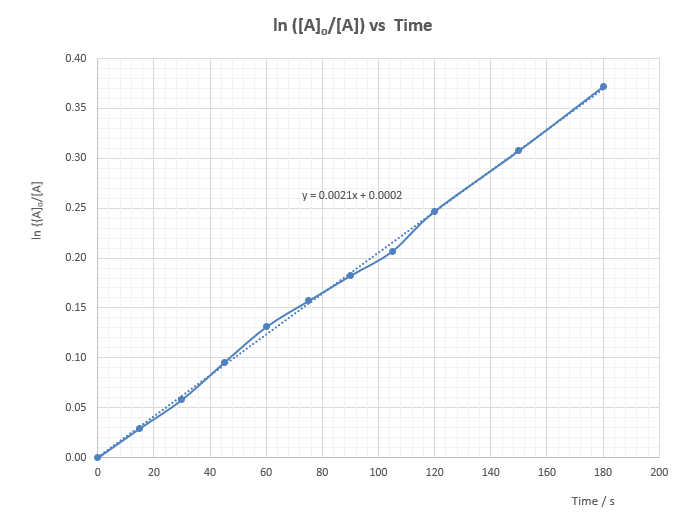
ln([A]o/[A]) 對 t作圖,得一斜率直線,通過XY軸 (0, 0) 點。反應物碘離子之反應級數是1。
實驗 (26) : 強鹼溶液酚酞退色之反應級數
(i) 實驗目的
1. 據酚酞和過量氫氧化鈉溶液反應,測定酚酞之反應級數。
2. 顯示酚酞於過量氫氧化鈉溶液退色之總反應級數為2。
(ii) 資料簡介
酚酞為一常用之酸/鹼指示劑,多用作酸/鹼滴定實驗測試終點。若過終點後繼續滴下鹼性反應物,令完成實驗之溶液為強鹼性,過了一段時間深粉紅色會慢慢退色。
酚酞為一弱酸,於水溶液進行如下電離:
H2P(aq) ![]() 2H+(aq) + Ph2-(aq)
2H+(aq) + Ph2-(aq)
無色 粉紅色
加入鹼溶液OH–(aq) 消耗酸離子, 令電離平衡往右移,無色溶液呈現粉紅色。反之加入酸溶液令電離平衡往左移,溶液變回無色。當溶液之pH 為8時,無色溶液變為粉紅色。若pH 持續增加粉紅色轉為深粉紅色。pH達致10或更高時,粉紅色慢慢退色,因Ph2- 和OH– 反應,生成無色絡離子P(OH)3- ,如下方程式所示:
Ph2-(aq) + OH-(aq) → P(OH)3-(aq)
粉紅色 無色
反應之速率定律式 (rate law) 用此方程式表達:Rate = k [Ph2-]n[OH–]m,n為Ph2- 之級數而m 為OH– 之級數。
(i) 應對實驗目的 (1),反應物OH–(aq) 刻意地過量使用。因如此OH–(aq) 濃度才可以反應前後變動不大,也可視為無變動,即為常數,m = 0。這情況下求得之對酚酞反應級數稱作動力學「假 (偽) 級數」“pseudo-order” 。
[Ph2-] 之減少速率 = 反應速率 = k [Ph2-]n[OH–]m
過量NaOH 情況下,反應速率 = kn[Ph2-]n, 而kn = k [OH–]m
對一級反應,n = 1,反應速率 = kn[Ph2-] 或 ln [Ph2-] = – knt + ln [Ph2-]o
Expt. (25) 之透光率 (T) 遞減,本實驗之透光率遞增,或吸光度 (absorbance, A) 遞減。[Ph2-] 和A,ln(1/T) ,成正比例。因此 (A) vs t 顯示 [Ph2-] 之衰變。驗視 [Ph2-] 之衰變圖,若連續t1/2 是一個常數,對Ph2- 而言是一級反應。另一方法是圖解ln (A) vs t,若得到一通過 (0 0) 點直線,斜率為負kn,也可驗證為一級反應。
(ii) 不可以用方法 (i) 應對另一反應物NaOH。不應用過量酚酞。針對方法 (ii),採納方法是改變NaOH濃度。因反應涉及Ph2- 和OH– 兩負電荷離子接近,靜電排斥不利反應。直接用水稀釋 NaOH加強這方面之缺點。因此稀釋時保持溶液全部離子濃度 (total ionic strength,離子强度) 不變是關鍵要素。針對這點,不是用水而是用惰性離子(spectator ion, 旁觀離子) 刻意地加入稀釋,令離子强度不變 (網上搜尋)。基於這點,加NaCl 溶液作稀釋。
反應: Ph2- + OH– → P(OH)3-
速率定律:Rate = k [Ph2-]n[OH–]m
Rate = kn [Ph2-]n, 其中 kn = k [OH–]m
考慮稀釋 n次之 (NaOH + NaCl) 混合溶液,圖解 ln (1/T) vs t之直線求得kn. 圖解kn vs [OH–] 應成一直線,因反應條件符合對OH– 動力級數為「假級數」一級之準則。另一圖解方法測定級數是以ln kn vs ln [OH–] 作圖,求直線之斜率 m。從相關方程式ln kn = ln k + m ln [OH–],斜率m就是對OH– 之反應級數。
(iii) 安全措施
配戴安全護鏡,不要讓皮膚接觸任何化學藥物。儘量用最少份量反應物料。按老師指示處理實驗步驟,化學藥物,過量物料和反應剩餘物。 |
|
(iii) 試劑和儀器
試劑 | 數量 | 儀器 | 數量 |
* 0.4 M NaOH | 25 cm3 | 自製比色計連接線 | 1 |
0.3 M NaCl | 15 cm3 | DMM | 1 |
酚酞指示劑 | 0.1% 溶液 | 膠比色杯 | 1 |
去離子水 | 適量 | 巴斯德移液管 | 3 |
| 10 cm3有刻度移液管 | 2 | |
100 cm3 燒杯 | 2 | ||
秒錶 | 1 | ||
攪拌玻璃棒 | 1 | ||
洗滌瓶內裝去離子水 | 1 | ||
鑷子 | 1把 | ||
保護膠手套 | 1對 | ||
*
(iv) 實驗步驟
(A) 測定反應對酚酞之動力「假級數」
1. DMM連接比色計,選擇 DC 2000 mV 檔。啟動比色計。
2. 用清潔巴斯德移液管,置50 滴4 M NaOH 於一清潔比色杯。用紙巾抹乾兩面透明面。放比色杯入比色杯槽倉至底部,蓋上蓋子。選擇綠色LED光源。調校旋鈕至顯示100 mV。對綠色LED光源校正步驟完成。保持旋鈕位置。
3. 戴上保護膠手套。用鑷子取出比色杯,小心加2滴酚酞指示劑。用手 (戴上膠手套) 覆蓋比色杯口,上下搖動三次。用紙巾抹乾兩面透明面,快速放入比色杯槽倉,蓋上蓋子,同一時間用秒錶計時。
4. 每隔15 秒紀錄 DMM 讀數,為時8分鐘或讀數沒有變化。完成表(2)。
(B) 定測反應酚酞退色對 OH–(aq) 之動力級數
1. 製備儲備溶液 (i) 至 (v) 如下:據表 (1) 方案,徹底混合4 M NaOH 和 0.3 M NaCl 。
完成表 (1)
溶液 | 0.4 M NaOH/ cm3 | 0.3 M NaCl/ cm3 | Molarity (OH)–(aq)/ M |
(i) | 10 | 0 | 0.40 |
(ii) | 9 | 1 | 0.36 |
(iii) | 8 | 2 | 0.32 |
(iv) | 7 | 3 | 0.28 |
(v) | 6 | 4 | 0.24 |
2. 用溶液 (ii)、(iii)、(iv) 和 (v) 重覆實驗 (A) 步驟 1 至 4。分別完成表 (3) 、(4)、(5) 和 (6) 。
(v) 實驗結果和數據處理
a. 定酚酞級數
溫度 = 22 oC
這部份和溶液 (i) 有關。完成表 (2):
表 (2):
1 / s | DMM 讀數 /mV | T | 1/T | ln (1/T) 或 (A) | ln(A) |
0 | 30.5 | 0.305 | 3.28 | 1.19 | 0.17 |
5 | 32.9 | 0.329 | 3.04 | 1.11 | 0.11 |
10 | 34.9 | 0.349 | 2.87 | 1.05 | 0.05 |
15 | 37.7 | 0.377 | 2.65 | 0.98 | -0.02 |
20 | 40.7 | 0.407 | 2.46 | 0.90 | -0.11 |
25 | 43.7 | 0.437 | 2.29 | 0.83 | -0.19 |
30 | 47.1 | 0.471 | 2.12 | 0.75 | -0.28 |
35 | 50.5 | 0.505 | 1.98 | 0.68 | -0.38 |
40 | 53.7 | 0.537 | 1.86 | 0.62 | -0.48 |
45 | 56.5 | 0.565 | 1.77 | 0.57 | -0.56 |
50 | 59.5 | 0.595 | 1.68 | 0.52 | -0.66 |
55 | 62.2 | 0.622 | 1.61 | 0.47 | -0.74 |
60 | 64.6 | 0.646 | 1.55 | 0.44 | -0.83 |
70 | 69.2 | 0.692 | 1.45 | 0.37 | -1.00 |
80 | 73.1 | 0.731 | 1.37 | 0.31 | -1.16 |
90 | 76.4 | 0.764 | 1.31 | 0.27 | -1.31 |
100 | 79.5 | 0.795 | 1.26 | 0.23 | -1.47 |
110 | 82.1 | 0.821 | 1.22 | 0.20 | -1.62 |
120 | 84.3 | 0.843 | 1.19 | 0.17 | -1.77 |
135 | 87.1 | 0.871 | 1.15 | 0.14 | -1.98 |
150 | 89.4 | 0.894 | 1.12 | 0.11 | -2.19 |
170 | 91.9 | 0.919 | 1.09 | 0.08 | -2.47 |
190 | 93.0 | 0.930 | 1.08 | 0.07 | -2.62 |
220 | 95.9 | 0.959 | 1.04 | 0.04 | -3.17 |
250 | 97.4 | 0.974 | 1.03 | 0.03 | -3.64 |
300 | 98.8 | 0.988 | 1.01 | 0.01 | -4.42 |
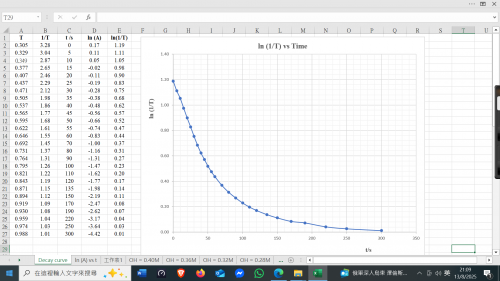
1, (A) vs t 作圖,測定首三個連續半衰期。
第一衰期 (A) 由 1.19下降至 0.60 需時 = 43 s
第二衰期 (A) 由 0.60下降至 0.30 需時 = 85 s
第三衰期 (A) 由 0.30下降至 0.15 需時 = 130 s
半衰期 | 時間/ s | 連續半衰期相差 / s |
第一 | 43 | 43 |
第二 | 85 | (85 – 43) =42 |
第三 | 130 | (130 – 85) = 45 |
首兩個半衰期一樣。第三個半衰期開始有偏差,因為顏色強度變得太弱。一般而言,對酚酞為一級反應。
2. 由 t = 0 s 至 t = 300 s 以ln (A) vs t作圖。測定直線之斜率k1。
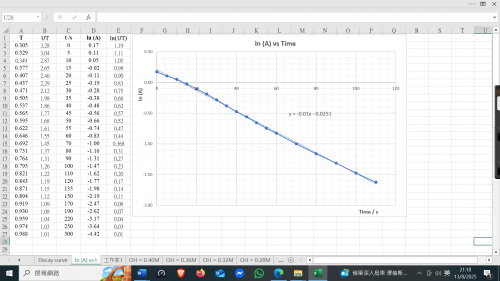
趨勢線為一直線顯示一級反應。斜率k1 = -0.01
Fading of phenophthalein in excess of OH-(aq) ion
b. 測定OH–(aq) 級數
溫度 = 22oC
這部份和溶液 (ii)、(iii)、(iv) 和 (v) 有關。完成表 (3)、(4)、(5) 和 (6)
Table (3), [OH–] = 0.36 M | Table (4), [OH–] = 0.32 M | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Table (5), [OH–] = 0.28 M | Table (6), [OH–] = 0.24 M | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
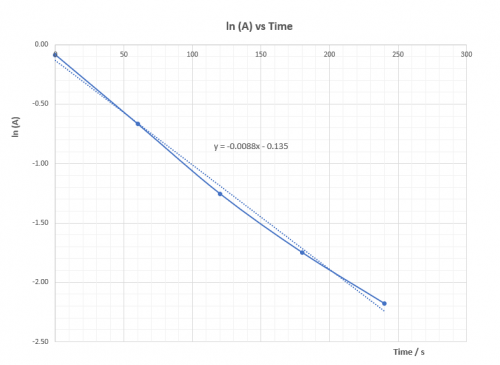 | 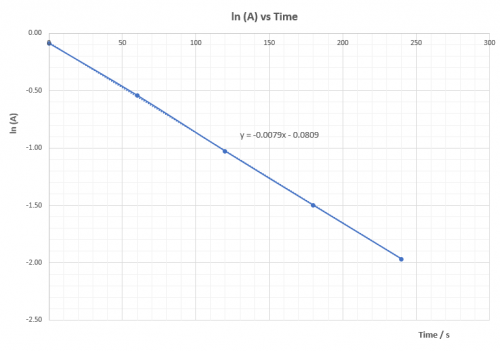 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
[OH–] = 0.36 M, k2 = -0.0088 | [OH–] = 0.32 M, k3 = -0.0079 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
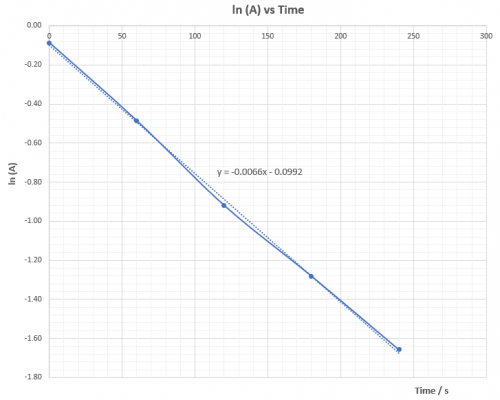 | 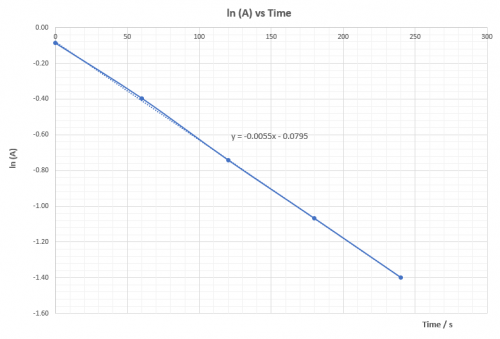 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
[OH–] = 0.286 M, k4 = -0.0066 | [OH–] = 0.24 M, k5 = -0.0055 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1. [OH–] vs kn作圖:
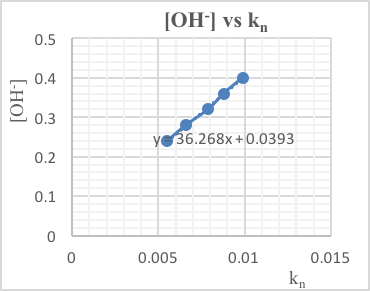
以上圖解顯示OH– 和kn 成正比例。按方程kn = k [OH–]m, m ~ 1 或對OH–為一級反應。
2. ln kn vs ln [OH–] 作圖:
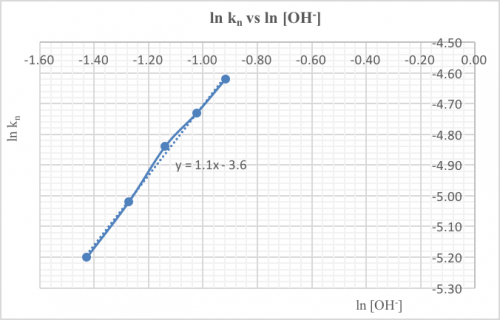
上圖直線之斜率 ~1。按方程式 kn = k[OH–]m 或 ln kn = ln k + m ln [OH–], m ~ 1顯示對OH–為一級反應。
(vi) 結論
酚酞指示劑於酸性溶液呈無色。當pH 數值上升至 8.2,酚酞變為粉統色。顏色繼續變深,pH 10 或以上呈現明亮品紅色 (magenta)。pH 值再上升時,顏色溶液退色。pH 值高於 13 則變為無色。
實驗數據顯示當反應環境處於過量OH–(aq) 時,酚酞退色為一級反應,或稱作「假,pseudo」一級反應。對OH–(aq) 也是一級 反應。酚酞在NaOH 溶液退色反 應總級數為 2。